Prolinegenskaper, struktur, funksjoner, mat
- 2663
- 158
- Prof. Theodor Gran
De Proline (Pro, P) tilhører de 22 aminosyrene klassifisert som grunnleggende. Det er en ikke -essensiell aminosyre, siden den kan syntetiseres av mennesker og andre pattedyrdyr.
I 1900 var den tyske forskeren Richard Willstatter den første som trakk ut og observerer prolinen. Imidlertid var det Emili Fischer, i 1901, som myntet begrepet "proline" basert på pyrrolidinringen til aminosyren; Denne forskeren klarte også å forklare i detalj syntesen av prolinen fra melkekaseinen.
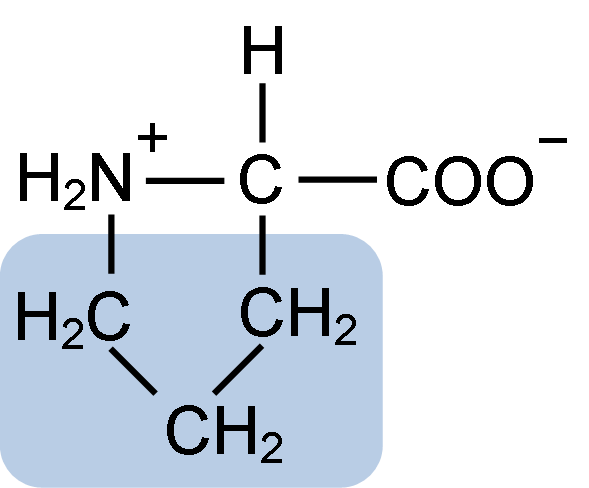
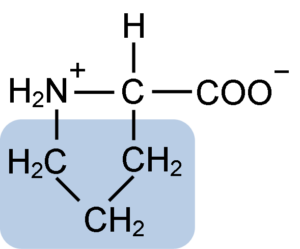 Kjemisk struktur av prolinaminosyre (kilde: clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons)
Kjemisk struktur av prolinaminosyre (kilde: clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons) I proteiner som kasein har prolin en uunnværlig funksjon i "svinger" og strukturell folding. I dette proteinet distribueres prolinen homogent gjennom strukturen og kobler til ß -kaseinet og aS1 -proteinet; I tillegg forhindrer det mangelfulle strukturelle løkker eller folding.
I de biokjemiske analysene som brukes for øyeblikket for å bestemme den eksakte sekvensen av aminosyrer som utgjør proteinene, er prolinen en av de vanskeligste deteksjons aminosyrene, siden den sekundære aminogruppen til prolinen har en annen oppførsel og ikke lett kan oppdages.
Scurvy er kanskje den mest kjente sykdommen relatert til prolin. Det har å gjøre med en mangel på C -vitamininntak, noe som direkte påvirker hydroksylering av prolinen i kollagenfibrene, noe som forårsaker systemisk svekkelse på grunn av ustabiliteten til kollagenfibrene som er i hele kroppen.
[TOC]
Kjennetegn
Den karbon -bundne sekundære aminogruppen α gjør prolinklassifiseringsoppgaven noe vanskelig. I noen tekster er dette imidlertid klassifisert ved siden av de forgrenede aminosyrene eller med alifatiske sidekjeder, siden sidekjeden eller r r av prolinen er hydrofob eller alifatisk.
En av de viktigste egenskapene til prolinen er at ikke i noe tilfelle kan hydrogenbroer dannes, noe som gjør det ideelt å strukturere komplekse og intrikate svinger i de tertiære strukturene til proteiner.
Akkurat som alle aminosyrer har to isoformer som er avhengig av det sentrale karbonatom, kan prolinen finnes i naturen som L-Proline eller som D-Prolol. Imidlertid er form L-Prolina den mest tallrike naturen og er den som er en del av proteinstrukturene.
I proteinene der det ligger, opptar prolinen ofte steder nær overflaten eller brettet eller "sving" av polypeptidkjeden, siden den stive og lukkede strukturen i prolinen gjør et sterkt interaksjon med annen aminosyre -interaksjon vanskelig.
Struktur
Prolinen har en spesiell struktur mellom basiske aminosyrer, siden den presenterer en aminogruppe (NH2) sekundær og ikke den primære aminogruppen som er karakteristisk for alle aminosyrer.
Gruppe R eller sidekjeden til prolinen er en pyrrolidin eller tetrahydropirrol -ring. Denne gruppen er dannet av en heterocyklisk amin (ingen dobbeltbindinger) av fem karbonatomer, hvor hver av disse er mettet med hydrogenatomer.
Prolinen har særegenheten at det "sentrale" karbonatom er inkludert i den heterocykliske pyrolidinringen, så de eneste "fri aminosyren.
Kan tjene deg: Superoksiddysmutase: Kjennetegn, struktur, funksjonerDen molekylære formelen til prolinen er C5H9NO2 og IUPAC-navnet er pirrolidin-2-karboksylsyre. Den har en omtrentlig molekylvekt på 115,13 g/mol og dens frekvens av utseende i proteiner er omtrent 7%.
Funksjoner
Kollagen- og tropokollagenfibre er de mest tallrike proteiner i de fleste virveldyr. Disse utgjør huden, sener, beinmatrise og mange andre vev.
Kollagenfibre består av mange trippelpolypeptidutløsere som igjen er sammensatt av flere prolin- og glycinrester i glycin-praktolin-prolin/hydroksiprololin-sekvensen (sistnevnte er et modifisert derivat av prolinen).
I sin opprinnelige form er prolinen en del av procollagen, dette er en forløper for polypeptidene til kollagenet og noen andre proteiner i bindevevet. Enzymet prolinhydroksylase.
Hva er hovedfunksjonen til prolinen i kollagenfibrene?
Hydroksyprolin gir kollagenresistensegenskaper, siden dette aminosyredarivatet har evnen til å danne et stort antall hydrogenbroer mellom trippel propellkjeder som utgjør proteinet.
Enzymene som katalyserer hydroksylering av prolinavfall, krever tilstedeværelse av C -vitamin (askorbinsyre), og som nevnt ovenfor skyldes skjørbuk Hydrogenbroer som opprettholder kollagenfibre.
Andre funksjoner
Proline er uunnværlig for dannelse av bretter og protein svinger.
Den lukkede strukturen gjør denne aminosyren vanskelig å "imøtekomme" inne i proteiner, i tillegg, siden den ikke kan danne hydrogenbroer for å "samhandle" med annet avfall i nærheten, induserer den dannelsen av "svinger" eller "svinger" langs proteinerstrukturen hvor det ligger.
Alle proteiner med kort levetid har minst en region med rikelig gjentatt prolin, glutamat, serin og treonin. Disse regionene går fra 12 til 60 avfall og kalles skadedyrsekvenser.
Proteiner som inneholder skadedyrsekvensen er preget av ubiquitinering for påfølgende nedbrytning i proteosomer.
Biosyntese
Mange aminosyrer kan syntetiseres fra glykolyse -mellommenn, av pentosefosfat eller sitronsyresyklusen (Krebs Cycle). Prolin og arginin dannes på de korte glutamatrutene.
Den tilnærmet vanlige biosyntetiske ruten for alle levende organismer begynner med konvertering av L-glutamat i y-L-glutamil-5-fosfat takket være virkningen av det glutamat-5-quinous enzym (i bakterier) eller av det y-glutamilen- Whinas (hos mennesker).
Denne reaksjonen innebærer ATP -avhengig fosforylering, så i tillegg til hovedproduktet genereres et ADP -molekyl.
The reaction catalyzed by glutamate 5-semi-limid dehydrogenase (in bacteria) or by the γ-glutamil reductase phosphate (in humans) converts the γ-l-glutamil-5-phosphate into L-glutamate-5-semi-limid Presence of CO -Factor Nadph.
Kan tjene deg: Half Stuart: Foundation, Preparation and UsesL-glutamato-5-semialdehydet er reversibelt og spontant dehydrert til (S) -1-1-pyrrool), i hvis reaksjon et molekyl av NADPH eller NADH også er nødvendig.
Nedbrytning
Prolin, arginin, glutamin og histidin blir stadig degradert til a-zetoglutarat for å komme inn i syklusen med sitronsyre eller Krebs-syklus. I det spesielle tilfellet av prolinen oksideres dette først av prolinoksidaseenzymet til pirrolin-5-karboksylat.
I det første trinnet, der oksidasjonen av prolinen til pirrolin-5-karboksylat oppstår, aksepteres de løsrevne protonene av E-FAD, og reduserer til E-FADH2; Dette trinnet er eksklusivt for prolinaminosyre.
På grunn av en spontan reaksjon, blir pirrolin-5-karboksylat transformert til y-semialdehyd glutamat, som deretter fungerer som et underlag for enzymet glutamat y-semi-limidisk dehydrogenase. I dette trinnet dukker det opp protoner, den ene av dem blir akseptert av NAD som er redusert til NADH, og den andre er gratis i form av H+.
Arginine, som prolinen, blir transformert til y-semialdehyd glutamat, men gjennom en alternativ metabolsk rute der to forskjellige enzymer deltar.
Y-semialdehyd glutamatenzymet dehydrogenase transformerer glutamat γ-semialdehyd til L-glutamat. Deretter oksideres dette L-glutamatet igjen av et enzym glutamatdehydrogenase, som til slutt danner a-zetoglutarat som vil bli inkorporert i sitronsyresyklusen.
I oksidasjonspassasjen av glutamat frigjøres et proton (H+) og en aminogruppe (NH3+). Protonet reduserer en NADP+ -gruppe og et NADPH -molekyl har opprinnelse.
Til tross for de mange likhetene som eksisterer mellom nedbrytnings- og biosynteseveiene til prolinen og argininet, blir disse aminosyrene syntetisert og nedbrutt av helt motsatte ruter som bruker forskjellige enzymer, forskjellige kofaktorer og som forekommer forskjellige intracellulære rom.
Mat rik på Valina
Generelt sett har all mat med høyt proteininnhold store mengder prolin. Blant disse er kjøtt, melk, egg og andre. Men når kroppen vår er i en optimal tilstand av helse og ernæring, er den imidlertid i stand til å syntetisere prolinendagen.
Prolinen kan også finnes i mange belgfrukter og nøtter og i fullkorn som havregryn, for eksempel. Andre prolinmat er hvetekli, nøtter, mandler, erter, bønner, blant andre.
Noen naturistbutikker formulerer vanligvis komprimert fra aminosyrene L-Lisina og L-Prololina kombinert for å hjelpe mennesker med leddproblemer eller for å utsette aldring av vev.
Imidlertid er det ikke påvist med sikkerhet at inntak av kosttilskudd av disse aminosyrene har en betydelig effekt på forsinkelsen av alderdom eller andre forhold for alderen for alderen.
Fordelene med inntaket ditt
Kosthold rike på prolin er vanligvis foreskrevet for personer som har leddsykdommer som leddgikt, forstuinger, leddbånd, dislokasjoner, senebetenn.
Kan tjene deg: agar m.R.S: Hva er, grunnlag, forberedelse, brukerMange av de farmakologiske kremer og tabletter som brukes i den estetiske industrien er beriket med L-prolin, siden noen studier har vist at denne aminosyren på en eller annen måte kan øke kollagensyntesen og derfor forbedre hudens tekstur, akselerere helbredelse av sår, lacerations, magesår og forbrenninger.
I matindustrien er det proteiner som har "bioaktive peptider" som trening fungerer utover ernæringsegenskapene sine. Disse peptidene har generelt to til ni aminosyreavfall som prolin, arginin og lysin florerer.
Disse bioaktive peptidene kan ha antihypertensiv aktivitet med en viss opioideffekt; De kan fungere som immunmodulatorer ved å stimulere immunresponsen mot noen patogener og kan til og med forårsake økning i vasoaktivitet, noe som forbedrer sirkulasjonen til de som bruker dem.
Mangelforstyrrelser
Gluten er et protein som er til stede i hvetekornene som forårsaker tarmbetennelse. Mennesker som lider av "glutenintoleranse" er kjent som "cøliaki" -pasienter, og det er kjent at dette proteinet er rikt på prolin og glutamin, hvis proteolytisk nedbrytning er vanskelig for personer med en slik tilstand.
Noen sykdommer har å gjøre med dårlig folding av viktige proteiner, og det er veldig vanlig at disse feilene har å gjøre med isomerisering Cis-trans av AMIDA -koblinger i prolinavfall, siden, i motsetning til andre peptidlenker der isomeren trans Det er veldig foretrukket, i prolinen er den vanskeligstilte.
I prolineavfall har det blitt observert at det er en betydelig tendens til dannelsen av isomeren Cis Først enn isomeren trans I de tilstøtende amidene til prolinavfall, som kan generere en "feil" konformasjon av proteiner.
Metabolske lidelser
Som med andre essensielle og ikke -essensielle aminosyrer, må de viktigste patologiske lidelsene relatert til prolinen gjøre, vanligvis med defekter på assimilasjonsveiene til denne aminosyren.
Hyperprolinemia er for eksempel et typisk tilfelle av mangel i en av enzymene som deltar i nedbrytningsveien for prolin, spesielt i 1-pyrolin-5-karboksylatdehydrogenase, noe som fører til en akkumulering av dets underlag, som til slutt inaktive ruten.
Denne patologien diagnostiseres vanligvis ved høyt prolininnhold i blodplasma og ved tilstedeværelsen av 1-pyrrololin-5-karboksylatmetabolitten i urinen til berørte pasienter som er berørt.
De viktigste symptomene på denne sykdommen består av nevrologiske lidelser, nyresykdommer og tap av auditiv kapasitet eller døvhet. Andre mer alvorlige tilfeller inkluderer alvorlig mental forsinkelse og markerte psykomotoriske vanskeligheter.
Referanser
- Abu-Baker, s. (2015). Gjennomgang av biokjemi: konsepter og forbindelser
- Delauney, a. J., & Verma, d. P. S. (1993). Prolinbiosyntese og osmoregulering i planter. Plant Journal, 4 (2), 215-223.
- Liste, b., Lerner, r. TIL., & Barbas, C. F. (2000). Prolinkatalyserte direkte asymmetriske aldolreaksjoner. Journal of the American Chemical Society, 122 (10), 2395-2396
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger prinsipper for biokjemi. Macmillan.
- Plimmer, r. H. TIL. (1912). Den kjemiske konstitusjonen av proteiner (volum. 1). Longmans, grønt.
- Szabados, l., & Savouré, til. (2010). Proline: En multifunksjonell aminosyre. Trender i plantevitenskap, 15 (2), 89-97.

