Vimentin -egenskaper, struktur, funksjoner og bruk
- 3361
- 134
- Prof. Theodor Gran
De Vimentina Det er en av de 57 kDa fibrøse proteiner som er en del av det intracellulære cytoskjelettet. Det er en del av de så -kalt mellomliggende filamentene og er den første av disse elementene som dannes i alle typer eukaryotisk celle. Det finnes hovedsakelig i embryonale celler, og forblir i noen voksne celler, for eksempel endotel og blod.
I mange år mente forskere at cytosol var en slags gel der celleorganeller fløt og det var proteiner i fortynning. Imidlertid erkjenner de for øyeblikket at virkeligheten er mer kompleks, og at proteiner danner et komplekst nettverk av filamenter og mikrotubuli som har kalt cytoskjelett.
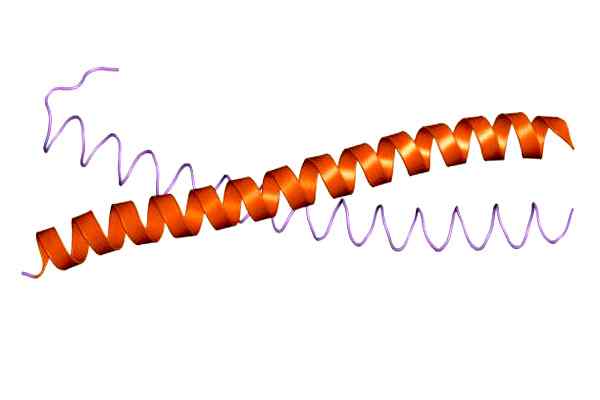
 Mellomfilamentprotein, rullet spoleområde, vimentin spole. Tatt og redigert fra: Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain Domain].[TOC]
Mellomfilamentprotein, rullet spoleområde, vimentin spole. Tatt og redigert fra: Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain Domain].[TOC]
Kjennetegn
Vimentin er et fibrøst mellomliggende filamentprotein, 57kda og inneholder 466 aminosyrer. Det er vanlig som en del av cellcytoskjelettet til mesenchymet, embryonal, endotel og vaskulær. Det er sjelden å finne dette proteinet i ikke -eukaryote organismer, men har likevel blitt isolert i noen bakterier.
Vimentina er lateral eller terminal til endoplasmatisk retikulum, mitokondrier og kjernen.
I virveldyrorganismer er vimentin et sterkt bevart protein og er nært beslektet med immunresponsen og kontroll og transport av lipider med lav tetthet.
Struktur
Vimentin er et enkelt molekyl, som, i likhet med alle mellomliggende filamenter, har et sentralt alfa-helikoidalt domene. I endene (hale og hode) presenterer den aminomonener (hode) og karboksyl (hale) uten helisk eller ikke -helisk.
Alfa-helikoidale sekvenser har et mønster av hydrofobe aminosyrer, som tjener eller bidrar til dannelsen av den hydrofobe tetningen på den spiralformede overflaten.
Cytoskjelettet
Som navnet tilsier, er det strukturell støtte fra eukaryote celler. Det går fra det indre ansiktet av plasmamembranen til kjernen. I tillegg til å tjene som et skjelett, slik at celler kan tilegne seg og opprettholde sin form, har det andre viktige funksjoner.
Det kan tjene deg: SGLT (natrium-glukosetransportproteiner)Blant disse er å delta i cellebevegelsen, så vel som i delingsprosessen. Den støtter også intracellulære organeller og lar dem aktivt bevege seg innenfor cytosolen, og delta i noen intercellulære fagforeninger.
I tillegg hevder noen forskere at enzymene som antas er i løsning i cytosol, de er virkelig forankret til cytoskjelettet, og enzymer på den samme metabolske ruten må være plassert i nærheten av hverandre.
Strukturelle elementer i cytoskjelettet
Cytoskjelettet har tre hovedstrukturelle elementer: mikrotubuli, mikrofilamenter og mellomliggende filamenter. Disse elementene finnes alene i eukaryote celler. Hvert av disse elementene har en karakteristisk intracellulær størrelse, struktur og distribusjon, og hver og en har også en annen komposisjon.
Mikrotubuli
Mikrotubuli er sammensatt av tubulin heterodimerer. De har en rørformet form, derav navnet deres, med en diameter på 25 nm og et hul sentrum. Er de største elementene i cytoskjelettet. Lengden varierer med mindre enn 200 nm og flere mikrometer lange.
Veggen er vanligvis dannet av 13 protofilamenter, ordnet rundt Lumen (hul). Det er to grupper av mikrotubuli: På den ene siden mikrotubuli av Axonema, relatert til bevegelse av cilia og Scourges. På den annen side er det cytoplasmatiske mikrotubuli.
De sistnevnte har forskjellige funksjoner, inkludert organisering og opprettholdelse av formen på dyreceller, samt nervecelleaksoner. De deltar også i dannelsen av mitotiske og meiotiske spindler under celledelinger, og veiledning og bevegelse av vesikler og andre organeller.
Mikrofilamenter
De er filamenter som er utgjort av aktin, et 375 aminosyreprotein og omtrent 42 kDa molekylvekt. Disse filamentene har en diameter mindre enn en tredjedel av diameteren på mikrotubulene (7 nm), noe som gjør dem til de minste filamentene i cytoskjelettet.
Det kan tjene deg: Jaliscos flora og fauna: Representative arterDe er til stede i de fleste eukaryote celler og har forskjellige funksjoner; Blant dem, delta i utvikling og vedlikehold av celleform. I tillegg deltar de i lokomotivaktiviteter, både Ameboid -bevegelse og i muskelsammentrekninger, ved interaksjon med myosin.
Under cytocinesis (cytoplasmatisk inndeling) er de ansvarlige for å produsere segmenteringsspor. Til slutt deltar de også i cellecelle- og ekstracellulære cellecelleforeninger.
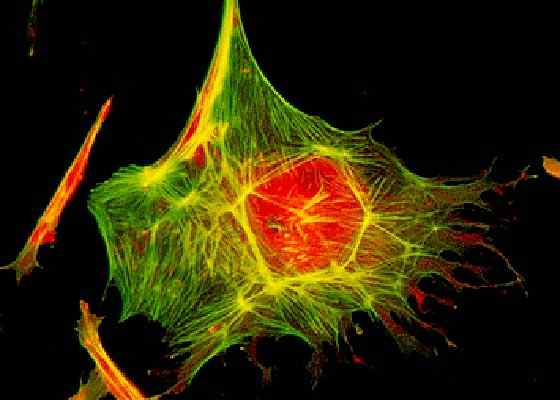 Cytoskjelett. Et nettverk av filamentøst protein av cellcytoplasma. Tatt og redigert fra: Alice Avelino [CC By-SA 4.0].
Cytoskjelett. Et nettverk av filamentøst protein av cellcytoplasma. Tatt og redigert fra: Alice Avelino [CC By-SA 4.0]. Mellomfilamenter
Med en omtrentlig diameter på 12 nm, er mellomliggende filamenter de som har størst stabilitet og er også den minst oppløselige av elementene som utgjør cytoskjelettet. De finnes bare i flercellede organismer.
Navnet er fordi størrelsen er mellom mikrotubuli og mikrofilamenter, så vel som mellom aktin- og myosinfilamenter i muskler. De kan bli funnet individuelt eller i gruppedannende.
De er dannet av et hovedprotein, og forskjellige tilbehørsproteiner. Disse proteinene er spesifikke for hvert vev. Mellomfilamenter finnes bare i flercellulær organisme, og i motsetning til mikrotubuli og mikrofilamenter, har de en veldig annen aminosyresekvens fra ett vev til et annet.
Basert på typen celle og/eller vev der de er, er mellomliggende filamenter gruppert i seks klasser.
Klasse I
Dannet av sure cytoqueratiner som gir mekanisk motstand mot epitelvev. Molekylvekten er 40-56,5 kDa
Klasse II
Det er de grunnleggende cytoqueratinene, som er litt tyngre enn de tidligere (53-67 kDa), og hjelper dem å gi mekanisk motstand mot epitelvevet.
Klasse III
Representert av vimentin, faller til GFA -proteinet, som hovedsakelig finnes i mesenchymceller (som allerede har blitt nevnt før), embryonal og muskel. De hjelper til med å gi sin karakteristiske form til hver av disse cellene.
Kan tjene deg: Biotiske og abiotiske faktorerKlasse IV
De er neurofilamentproteiner. I tillegg til å gi stivhet til nervecelleaksoner, bestemmer de også størrelsen på disse.
Klasse V
Representert av arkene som danner kjernefysisk stillas (atomark). De er til stede i alle typer celler
Klasse VI
Dannet av Nestina, et 240 kDa molekyl funnet i nervestamceller og hvis funksjon forblir ukjent.
Vimentin -funksjon
Vimentin deltar i mange fysiologiske prosesser, men fremhever hovedsakelig å tillate og motstand mot cellene som inneholder det, og unngår celleskade. De beholder organeller i cytosol. De deltar også i unionen, migrasjonen og signaliseringen av celler.
applikasjoner
Doktor
Medisinske studier indikerer at vimentin fungerer som en markør for celler avledet fra mesenchymet, under normal og progressiv utvikling av kreftmetastase.
Andre studier indikerer at immunantistoffer eller celler som inneholder VIM -genet (gen som koder for vimentin), kan brukes som markører i histopatologi og ofte for å oppdage mesenkymale svulster og epitel.
Farmasøytisk og bioteknologi
Farmasøytiske og bioteknologiske næringer har utnyttet egenskapene til Vimentin og brukt den til produksjon av et viktig utvalg av produkter som antistoffer designet med genetisk ingeniørvitenskap, vimentinas proteiner, ELISA -sett og komplementære DNA -produkter, blant mange andre.
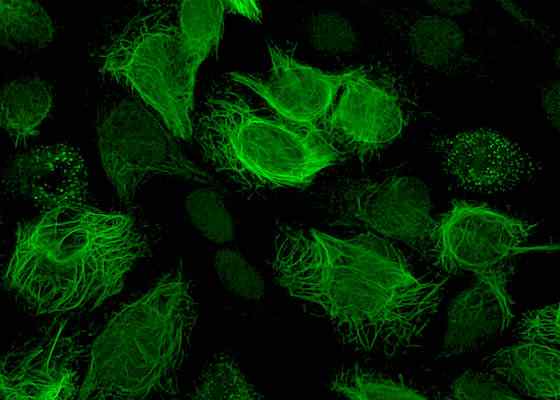 Immunofluorescensmønster av antistoffer mot vimentin. Produsert ved hjelp av et pasientserum i HEP-20-10 celler med en FITC-konjugat. Tatt og redigert fra: Simon Caulton [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)].
Immunofluorescensmønster av antistoffer mot vimentin. Produsert ved hjelp av et pasientserum i HEP-20-10 celler med en FITC-konjugat. Tatt og redigert fra: Simon Caulton [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Referanser
- Hva er vimentin? Gjenopprettet fra: TechnologyNetworks.com.
- M.T. Fit & c. Jacobs-Wagner (2010). Det bakterielle cytoskjelettet. Årlig gjennomgang av genetikk.
- Vimentin. Innhentet fra.Wikipedia.org.
- W.M. Becker, l.J. Kleinsmith & J. Hardin. (2006). Verden av cellen. 6th Utgave. Pearson Education Inc,
- H. Herrmann, & u. AEBI (2000). Mellomfilamler og deres medarbeidere: Multi-tatidede strukturelle elementer som spesifiserer cytoararkitektur og cytodynamikk. Nåværende mening i cellebiologi
- D.OG. Ingber (1998). Livets arkitektur. Scientific American.
- « Kvartærstruktur av egenskaper proteiner
- Avogadro nummer historie, enheter, hvordan det beregnes, bruker »

