Kvartærstruktur av egenskaper proteiner

- 1392
- 123
- Anders Mathisen
De Kvartær struktur av proteiner definerer romlige forhold mellom hver av underenhetene av polypeptider knyttet sammen av ikke -kovalente krefter. I polymere proteiner kalles hver av polypeptidkjedene som utgjør det underenheter eller protomerer.
Proteiner kan dannes av en (monomer), to (dimérica), flere (oligomere) eller mange protomerer (polymer). Disse protomerer kan ha en lignende eller veldig forskjellig molekylstruktur mellom dem. I det første tilfellet sies det at de er homotypiske proteiner og i det andre tilfellet heterotypisk.
 Eksempel på en kvartærstruktur av et spredningscelle nukleær antigenprotein. Tatt og redigert fra: Thomas Shafee [CC av 4.0 (https: // creativecommons.Org/lisenser/av/4.0)].
Eksempel på en kvartærstruktur av et spredningscelle nukleær antigenprotein. Tatt og redigert fra: Thomas Shafee [CC av 4.0 (https: // creativecommons.Org/lisenser/av/4.0)]. I vitenskapelig notasjon bruker biokjemikere greske bokstaver med abonnement for å beskrive sammensetningen av proteinprotomerer. For eksempel er et tetramerisk homotypisk protein betegnet som α4, Mens et tetramerisk protein dannet av to forskjellige dimerer er betegnet som α2β2.
[TOC]
Proteinstruktur
Proteiner er komplekse molekyler som får forskjellige tre -dimensjonale konfigurasjoner. Disse konfigurasjonene er eksklusive for hvert protein og lar dem utføre veldig spesifikke funksjoner. Nivåene i strukturell organisering av proteiner er følgende.
Primærstruktur
Det refererer til sekvensen der de forskjellige aminosyrene i polypeptidkjeden er anordnet. Denne sekvensen er gitt av DNA -sekvensen som koder for et slikt protein.
Sekundær struktur
De fleste proteiner er ikke lange kjeder med fullstendig utvidede aminosyrer, men har regioner som regelmessig brettes i form av propeller eller ark. Denne foldingen er den som kalles sekundærstruktur.
Tertiær struktur
De brettede områdene i sekundærstrukturen kan igjen brette og samles i mer kompakte strukturer. Denne siste folden er den som gir proteinet sin tre -dimensjonale form.
Kvartær struktur
I proteinene som er dannet av mer enn en underenhet, er de kvartære strukturene de romlige forholdene som eksisterer mellom hver underenhet, som er koblet sammen med ikke -kovalente bindinger.
Kan tjene deg: hvordan sopp puster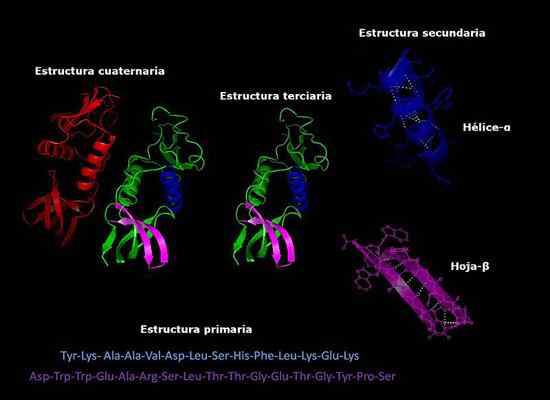 Primære, sekundære, tertiære og kvartære strukturer av proteiner, tre -dimensjonal konformasjon. Tatt og redigert fra: Alejandro Porto [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)].
Primære, sekundære, tertiære og kvartære strukturer av proteiner, tre -dimensjonal konformasjon. Tatt og redigert fra: Alejandro Porto [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Stabiliteten til den kvartære strukturen
Den tre -dimensjonale strukturen av proteiner er stabilisert ved svake eller ikke -kovalente interaksjoner. Selv om disse koblingene eller interaksjonene er mye svakere enn normale kovalente bindinger, er disse mange og deres kumulative effekt er kraftig. Neste vil vi se noen av de vanligste interaksjonene.
Hydrofobe interaksjoner
Noen aminosyrer inneholder hydrofobe sidekjeder. Når proteiner har disse aminosyrene, bestiller foldingen av molekylet disse sidekjedene inn i proteinet og beskytter dem mot vann. Naturen til de forskjellige sidekjedene får dem til å bidra på forskjellige måter i den hydrofobe effekten.
Van der Waals -interaksjoner
Disse interaksjonene oppstår når molekyler eller atomer som ikke er forent ved kovalente bindinger, nærmer seg for mye mellom dem, og på grunn av det begynner deres ytterste elektroniske orbitaler å overlappe hverandre.
På den tiden etableres det en frastøtningskraft mellom disse atomene som vokser veldig raskt etter hvert som deres respektive sentre er omtrent. Dette er de så kalt van der Waals "Forces".
Lastbelastningsinteraksjoner
Det er den elektrostatiske interaksjonen som oppstår mellom et par belastede partikler. Hos proteiner forekommer denne typen interaksjoner, både på grunn av netto elektrisk ladning av proteinet, og den individuelle belastningen på ionene som er inneholdt inne. Denne typen interaksjoner kalles noen ganger Puente Salino.
Hydrogenbindinger
En hydrogenbinding er etablert mellom et tilknyttet hydrogenatom, med måter.
Denne typen bindinger er veldig viktig, siden egenskapene til mange molekyler, inkludert vann og biologiske molekyler, i stor grad skyldes hydrogenbindinger. Del egenskapene til kovalente bindinger (elektroner deles) og også av ikke-kovalente interaksjoner (interaksjon mellom lastbelastning).
Kan tjene deg: forbigående avlingerDipolos -interaksjoner
I molekyler, inkludert proteiner, som ikke presenterer nettbelastning, kan en ikke -ulik disposisjon av deres indre belastninger sendes inn, med en litt mer negativ slutt enn en annen. Dette er det som er kjent som en dipol.
Denne dipoltilstanden til molekylet kan være permanent, men den kan også induseres. Dipolos kan tiltrekkes av ioner eller andre dipoler. Hvis dipolene er permanente, har interaksjonen større omfang enn det som presenteres med induserte dipoler.
I tillegg til disse ikke -kovalente interaksjonene, stabiliserer noen oligomere proteiner sin kvartære struktur ved hjelp av en kovalent koblingstype, disulfidkoblingen. Disse er etablert mellom sulfhydrillogruppene av cysteonene i forskjellige protomerer.
Disulfuro -bindinger bidrar også til å stabilisere den sekundære strukturen til proteiner, men i dette tilfellet kobles cysteinavfall inne i det samme polypeptidet (intrapopolipeptiddisulfidkoblinger).
Interaksjoner mellom protomerer
Som nevnt før, i proteiner som består av flere underenheter eller protomerer, kan disse underenhetene være like (homotypiske) eller forskjellige (heterotypiske).
Homotypiske interaksjoner
Underenhetene som utgjør et protein er asymmetriske polypeptidkjeder. I homotypiske interaksjoner kan imidlertid disse underenhetene assosieres på forskjellige måter å oppnå forskjellige typer symmetri.
Gruppene som samhandler med hver protomere er generelt lokalisert i forskjellige posisjoner, så de kalles heterologe interaksjoner. Heterologe interaksjoner mellom de forskjellige underenhetene, noen ganger forekommer på en slik måte at hver underenhet er skjev med hensyn til presedensen, en spiralisk struktur og en spiralformet struktur kan oppnås.
Ved andre anledninger er interaksjonene gitt på en slik måte at definerte underenhetsgrupper er ordnet rundt en eller flere symmetriakser, i det som er kjent som punkt - gruppesymmetri. Når det er flere symmetriakser, er hver underenhet ødelagt med hensyn til dens 360 °/n nabo (hvor n representerer antall akser).
Det kan tjene deg: australsk flora og fauna: representative arterBlant typer symmetri som er oppnådd på denne måten er for eksempel spiralform, kubikk og icosahedral.
Når to underenheter samhandler gjennom en binær akse, er hver enhet ødelagt 180 ° med hensyn til den andre, rundt den aksen. Denne symmetrien er kjent som symmetri c2. I den er samhandlingsstedene i hver underenhet identiske; I dette tilfellet er det ingen snakk om heterologinteraksjon, men om en isolog interaksjon.
Hvis assosiasjonen mellom de to komponentene i dimeren er heterolog, vil en asymmetrisk dimer oppnås.
Heterotypiske interaksjoner
Ikke alltid underenhetene som samhandler i et protein er av samme art. Det er proteiner som dannes av tolv eller flere forskjellige underenheter.
Interaksjonene som opprettholder stabiliteten til proteinet er de samme som i homotypiske interaksjoner, men fullstendig asymmetriske molekyler oppnås generelt.
Hemoglobin er for eksempel en tester som presenterer to par av forskjellige underenheter (α2β2).
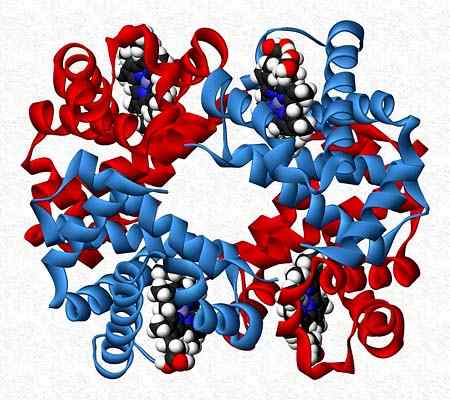 Kvaternær struktur av hemoglobin. Tatt og redigert fra: Benjah-BMM27. Modifisert av Alejandro Porto. [CC0].
Kvaternær struktur av hemoglobin. Tatt og redigert fra: Benjah-BMM27. Modifisert av Alejandro Porto. [CC0]. Referanser
- C.K. Mathews, k.OG. Van Hold & K.G. Ahern (2002). Biochemery. 3. utgave. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, p. Mayes, d.C. Granner & V.W. Rodwell (1996). Harper's Biochemery. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & l. Stryer (2002). Biochemery. 5. utgave. W. H. Freeman og selskap.
- J. Koolman & K.-H. Roehm (2005). Atlas of Biochemistry Color. 2. utgave. Thieme.
- TIL. Lehninger (1978). Biokjemi. Omega Editions, S.TIL.
- L. Stryer (1995). Biochemery. W.H. Freeman og Company, New York.
- « 1800 -tallet i Chile befolkning, samfunn, økonomi og politikk
- Vimentin -egenskaper, struktur, funksjoner og bruk »

