Flyktighet

- 2222
- 297
- Jonathan Moe
 Når vann varmes opp i en plate til det oppstår damp, oppstår flyktiggjøring. Med lisens
Når vann varmes opp i en plate til det oppstår damp, oppstår flyktiggjøring. Med lisens Hva er flyktiggjøring?
De flyktighet Det er prosessen med å konvertere et kjemikalie av flytende eller fast tilstand til en gassform eller damp. Andre begrep som brukes for å beskrive den samme prosessen er fordamping, destillasjon og sublimering.
Et stoff kan ofte skilles fra en annen ved flyktning, og kan utvinnes ved dampkondensasjon.
Stoffet kan flyktes raskere, enten varme det for å øke damptrykket eller ved å dampe, ved hjelp av en inert gasstrøm eller en vakuumpumpe.
Oppvarmingsprosedyrer inkluderer flyktighet av vann, kvikksølv eller arsen triklorid for å skille disse stoffene fra de interferensielle elementene.
Noen ganger brukes kjemiske reaksjoner for å produsere flyktige produkter, som ved frigjøring av karbondioksid fra karbonater, ammoniakk i Kjeldahl -metoden for bestemmelse av nitrogen og svoveldioksid i bestemmelsen av stål svovel.
Volatiliseringsmetoder er generelt preget av stor enkelhet og enkel drift, bortsett fra når det er svært motstandsdyktig mot korrosjonsbestandig eller materialer er nødvendig.
Volumtrykk flyktning
Når du vet at koketemperaturen på vann er ved 100 ° C, er det relevant å spørre hvorfor regnvann fordamper. Hvis det er ved 100 ° C, skal det gi oss varme.
Det er også verdt å spørre hva den karakteristiske aromaen gir alkohol, eddik, tre eller plast.
Personen som er ansvarlig for alt dette er en eiendom kjent som damptrykk, som er trykket som utøves av en damp i likevekt med den faste eller væskefasen av samme stoff. Også det delvise trykket av stoffet i atmosfæren på fast eller væske.
Damptrykket er et mål på tendensen til et materiale som skal endres til gassformig eller damptilstand, det vil si et mål på stoffvolatilitet.
Det kan tjene deg: karbondisulfid (CS2): Struktur, egenskaper, bruksområder, risikoNår damptrykket øker, desto større er kapasiteten til væsken eller det faste stoffet å fordampe, og dermed være mer flyktig.
Damptrykket vil øke med temperaturen. Temperaturen som damptrykket på overflaten av en væske er lik trykket som utøves av miljøet, kalles væskekokepunktet.
Damptrykket vil avhenge av løsningen oppløst i løsning (det er en kollegativ egenskap). På overflaten av løsningen (luft-lav grensesnitt) har de mest overfladiske molekylene en tendens til å fordampe, utveksle mellom faser og generere damptrykk.
Tilstedeværelsen av oppløst stoff reduserer antall løsningsmiddelmolekyler ved grensesnittet, og reduserer damptrykket.
Endringen i damptrykket kan beregnes med Raaults lov for ikke -flyktige oppløsninger, som er gitt av:
(1)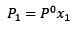 Der P1 er damptrykket etter å ha tilsatt oppløsningen, er X1 den molære fraksjonen av nevnte løst stoff og P ° er damptrykket til det rene løsningsmidlet.
Der P1 er damptrykket etter å ha tilsatt oppløsningen, er X1 den molære fraksjonen av nevnte løst stoff og P ° er damptrykket til det rene løsningsmidlet.
Hvis summen av de molære fraksjonene av oppløsningen og løsningsmidlet er lik 1, har vi:
(2)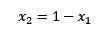
Der x2 er den molære fraksjonen av løsningsmidlet. Hvis vi multipliserer begge sider av ligningen med P °, gjenstår det:
(3)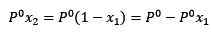
Erstatning (1) i (3) gjenstår:
(4)
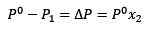
Dette er variasjonen av damptrykket når et løst oppløses oppløses.
Gravimetrisk analyse
Gravimetrisk analyse er en klasse av laboratorieteknikker som brukes for å bestemme massen eller konsentrasjonen av et stoff ved å måle en masseendring.
Kjemikeren vi prøver å kvantifisere kalles noen ganger analyt. Vi kan bruke den gravimetriske analysen til å svare på spørsmål som:
Kan tjene deg: metallmineraler- Hva er konsentrasjonen av analytten i en løsning?
- Hvor ren er prøven vår? Prøven her kan være en solid eller i løsning.
Det er to vanlige typer gravimetrisk analyse. Begge involverer endring av analytfasen for å skille den fra resten av en blanding, noe som gir opphav til en endring i deigen.
En av disse metodene er nedbør gravimetri, men den som virkelig interesserer oss er volatilisering av gravimetri.
Volatilisering gravimetri er basert på termisk eller kjemisk prøven og måler den resulterende endringen i massen.
Alternativt kan vi fange og veie et flyktig produkt av nedbrytning. Fordi frigjøring av en flyktig art er en essensiell del av disse metodene, klassifiserer vi dem samlet som gravimetrisk volatiliseringsanalysemetoder.
Gravimetriske analyseproblemer er ganske enkelt støkiometriproblemer med noen få ekstra trinn.
For å utføre enhver støkiometrisk beregning, trenger vi koeffisientene til den balanserte kjemiske ligningen.
For eksempel, hvis en prøve inneholder urenheter av dihydrert barium (BACL2● H₂o), kan du få mengden urenheter som varmer prøven for å fordampe vannet.
Masseforskjellen mellom den opprinnelige prøven og den oppvarmede prøven vil gi oss, i gram, mengden vann som finnes i bariumklorid.
Med en enkel støkiometrisk beregning vil mengden urenheter i prøven oppnås.
Fraksjonert destillasjon
Fraksjonell destillasjon er en prosess der komponentene i en flytende blanding skilles i forskjellige deler (kalt fraksjoner) i henhold til deres forskjellige kokepunkter.
Volatilitetsforskjellen på blandingene av blandingen spiller en grunnleggende rolle i dens separasjon.
Kan tjene deg: oktettregelFraksjonell destillasjon brukes til å rense kjemikalier og også for å skille blandinger og oppnå sine komponenter. Det brukes som laboratorieteknikk og i bransjen, der prosessen har stor kommersiell betydning.
Dampene til en kokende løsning føres langs en høy kolonne, kalt underavdelingskolonne.
Kolonnen er fullpakket med plast eller glassperler for å forbedre separasjonen, og gir mer overflateareal for kondens og fordampning.
Kolonnetemperaturen avtar gradvis langs lengden. Komponentene med et høyere kokepunkt blir kondensert i kolonnen og går tilbake til løsningen.
De nedre kokepunktene komponenter (mer flyktige) passerer gjennom kolonnen og samles nær toppen.
Teoretisk forbedrer det å ha flere perler eller plater separasjonen, men tilsetningen av plater øker også tiden og energien som kreves for å fullføre en destillasjon.
Volatiliseringseksempler
- En blokk med tørris i kontakt med en luftutbrudd. Luften begynner flyktighetsprosessen og isen fordamper: den går fra fast tilstand til brus.
- Når vann eller annet stoff kokes: Varme genererer damp, og dermed passerer vann fra flytende tilstand til gassformig.
- Naftalinpillene, som gradvis ødelegger og passerer fra fast tilstand til brus.
- Når fast svovel blir utsatt for høye temperaturer, blir det giftige gasser. Det vil si at det går fra solid til gassformig.
- Aromatiserende piller: De har samme prosess som naftalinpiller, gradvis forringes og blir gass, lukt og ufarlig.
Referanser
- Trykkdefinisjon damp. Gjenopprettet fra Thoughtco.com.
- Damptrykk. Gjenopprettet fra Britannica.com.

