Kloroksid (iii) egenskaper, struktur, bruk
- 5093
- 965
- Mathias Aas
Han Kloroksid (III) Det er en uorganisk forbindelse med kjemisk formel CL2ENTEN3. Tilsvarer anhydrid av klorsyre, Hclo2. Det er et mørkebrunt fast, svært eksplosivt selv ved temperaturer under 0 ºC, og dårlig karakterisert. Det er derfor det er utsatt for interesse for datastudier.
Kjemisk er det et kovalent oksid, så det er CL-O-bindinger og et diskret molekyl av CL2ENTEN3 (Nedre bilde). Dette molekylet kan godt danne dehydrering av HClo2, eller ved å utsette det for lave temperaturer. Detaljene er at den dekomponerer å produsere CL2, ENTEN2, eller andre termodynamisk mer stabile kloroksider.
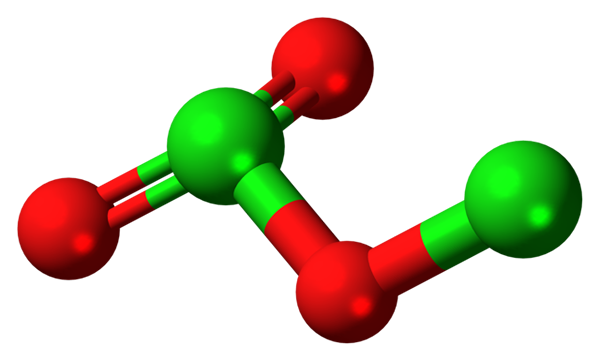
 Dicloro trioksidmolekyl. Kilde: Jynto [CC0].
Dicloro trioksidmolekyl. Kilde: Jynto [CC0]. Ettersom CL-O-obligasjonene er lite polar, CL-e-post2ENTEN3 Den har et lite dipolmoment; Derfor oppløses det ikke godt i vann eller samhandler med andre polare løsningsmidler. Ustabiliteten er slik at den ikke er kjent kommersiell eller potensiell bruk (eller som et eksplosivt anvendbarhet vil være levedyktig).
Hovedårsaken til ustabiliteten kan skyldes de elektroniske egenskapene til den påståtte CL3+ (Forutsatt en rent ionisk karakter). Faktisk er oksidasjonen +1 og +5 tilstander de mest stabile når klor danner forbindelser med oksygen.
[TOC]
Egenskaper
Fordi karakteriseringen er dårlig og ikke dokumentert, er det ikke mye å si om dens egenskaper bortsett fra følgende punkter:
-Den har en molekylmasse på 118.903.
-Det er en solid mørkebrun; Selv om du kan sublimisere gassformig klor, sier gulaktige grønne damper.
-Det mangler både kokende og fusjonspunkt, siden det ved 0 ºC eksploderer (og også ved kaldere temperaturer).
Kan tjene deg: dihydroxyacetone fosfat (DHAP): Kjennetegn og applikasjoner-Dens løselighet i vann er estimert rundt 3,42 g/100 ml, noe som beviser at det er et kovalent molekyl med lav polaritet.
-Reagerer med vann (det lille som løses opp) for å bli HClo2:
Cl2ENTEN3 + H2Eller 2hclo2
Kloroksydstruktur (III)
I bildet ble molekylstrukturen til CL vist2ENTEN3 Med en sfærer og barmodell. Selv om det ikke ser ut til det blotte øye, er de stilltiende implikasjonene av deres romlige koblinger og arrangementer mer kompliserte enn de ser ut. Denne strukturen tilsvarer en av de mange mulige isomerer for denne forbindelsen.
De røde kulene tilsvarer oksygenatomer, og de grønne til kloratomer. Kloren til venstre presenterer trigonal pyramidgeometri, med et par gratis elektroner; Så det kan antas at hybridiseringen din må være SP3. Et oksygenatom fungerer som en bro mellom de to klorene, CL-O-CL.
Isomerer
Hva er de andre isomerer? I teorien beregnes ni, hvorav fire er de mest stabile (inkludert bildet). De tre andre ville ha strukturer som:
-Clclo3. Veldig lik den som er forklart, men med en CL-Cl-lenke.
-Clooocl (1). I denne isomeren er det en bro med tre oksygen som skiller de to kloratomene (husk vinkelgeometrien til H2Eller å visualisere det).
-Clooocl (2). Den samme oksygenerte broen er også til stede i denne isomeren, med unntak av de to kloratomene er formørket i verdensrommet; den ene foran den andre, mens de i forrige isomer er fjerne.
Det kan tjene deg: AlquinosNomenklatur
Navnet, kloroksyd (III), tilsvarer det tilordnede i henhold til bestandsnomenklaturen. Her antas det at klor har en oksidasjonstilstand på +3; Men det betyr ikke at CL -kationen3+ kan være til stede. Det er et molekyl, ikke et ionettverk.
Et annet navn som CL også er kjent2ENTEN3 Det er dicloro -trioeksid, i henhold til den systematiske nomenklaturen.
Og finale. Dette navnet skyldes det faktum at CL som allerede forklart CL2ENTEN3 Det oppstår når HCLO2 Det kondenserer vannvann.
applikasjoner
Fordi det er et kloroksyd, den mest umiddelbare bruken som kan tenkes for CL2ENTEN3 Det er som et oksidasjonsmiddel, i stand til å nøytralisere organiske urenheter og mikrober. Imidlertid er det veldig ustabilt, i tillegg til eksplosivt, slik at det for dette formålet anses som nyttig.
Det er helt sikkert ingen informasjon selv om hvordan CL ville oppføre seg2ENTEN3 under stort trykk (hvis det ikke eksploderer i prosessen). Under normale forhold ser det ut til å være noe mer enn en relativt stabil og differensierbar mellomledd blant andre mer stabile kloroksider.
Beregningsmessig har det imidlertid vært underlagt å studere for å bestemme mekanismer ved frie radikaler som involverer flere arter av klor og oksygen.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Trioxide Dichlorine. Hentet fra: i.Wikipedia.org
- Gi ham l. Perry. (2011). Håndbok med uorganiske forbindelser. (Andre utgave). CRC Press Taylor & Francis Group.
- Richard c. Ropp. (2013). Encyclopedia av de alkaliske jordforbindelsene. Elsevier.
- Kim k. H., Han og.K., og les og. S. (1999). Basis Set Effekter på stabiliteten til CL2O3 -isomerer ved bruk av B3P86 og B3LYP -metoder for tetthetsfunksjonsteori. Journal of Molecular Structure Theochem 460 (1-3): 19-25.
- « Jernhydroksyd (II) struktur, egenskaper, bruk
- Tetrodotoksinstruktur, egenskaper, bruksområder, effekter »

