Jernhydroksyd (II) struktur, egenskaper, bruk
- 4717
- 1020
- Markus Fredriksen
Han Jernhydroksyd (II), Også kalt jernhydroksyd, det er en uorganisk forbindelse av tro kjemisk formel (OH)2. Hvis renheten er høy, er det faste stoffet bare sammensatt av trosioner2+ Og åh- I et forhold på 2: 1; Imidlertid kan vannmolekyler og forskjellige ioniske arter inneholde, og endre posisjonen.
Representerer den "reduserte" formen for den berømte rust, rødlig overflate sammensatt av trosioner3+; Mens du er i grønnaktig rust, dominerer troen2+, ved siden av OH- og en annen mengde anioner: CO32-, SW42-, NEI3- og haluro (f-, Cl-,… ), For eksempel. Resultatet, selv om basen til denne grønne rust er tro (OH)2, er at forskjellige faste stoffer oppnås.
 Grønt oksid på jernoverflate: Kildemateriale av denne typen hydroksid. Kilde: Pixabay.
Grønt oksid på jernoverflate: Kildemateriale av denne typen hydroksid. Kilde: Pixabay. I dagliglivet kan dette hydroksydet tenkes på vanlige steder. For eksempel har det øvre bildeskipet sin dekkede overflate av grønn rust (ikke patina). Det er troen (OH)2, men ledsaget av mange ioner fra havbølgene.
Kjemisk sett avhenger egenskapene og bruken av dette materialet av troskation2+ og av hans tendens til å oksidere til å forvandle seg til tro3+. Det er et reduserende middel, som reagerer raskt med oksygen under grunnleggende forhold. Derfor bør det brukes i inerte atmosfærer og syreoppløsninger.
[TOC]
Jernhydroksydstruktur (II)
Lenker
Vurderer bare tro (OH)2 Ren, det er ikke noe mer trosioner2+ Og åh-.
Interaksjonene mellom dem må i teorien av ionisk natur; Hver tro tro2+ tiltrekker seg to anioner oh-, hvis ikke -retningsattraksjoner ender opp med å etablere en strukturell og repeterende orden som definerer en krystall; som igjen gir opphav til grønt ruststøv.
Det kan tjene deg: sinkhydroksid (Zn (OH) 2)Problemet er at det er en viss kovalent karakter mellom begge ionene, og derfor kan ikke en ionisk Fe-OH-kobling ignoreres. Tatt i betraktning en delvis ionisk Fe-OH-kobling, kan det forstås at de er gruppert i et slags polymerlag.
Doble lag med hydroksyd
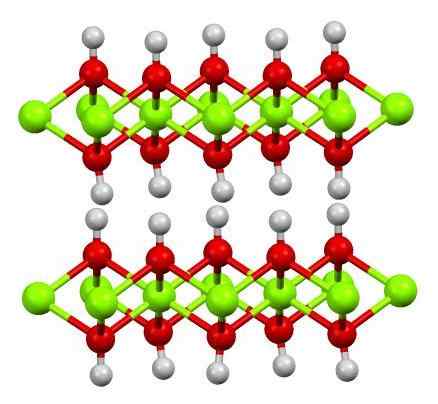
 Troestruktur (OH) 2. Kilde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Troestruktur (OH) 2. Kilde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Strukturen av rent jernhydroksid med en modell av kuler og stenger er vist ovenfor. Fe -kationer2+ De er representert av Chillón Green Spheres, mens Oh -anioner- For de røde og hvite kulene. Legg merke til hvordan trosioner er justert2+ Takk til interaksjonene (ionisk-kovalent) med OH-.
Hvorfor er denne strukturen doble lag med hydroksider? Selve bildet gir svaret: det er to rader eller lag med OH- For hver tro2+; det vil si at andelen 2: 1 av tro (OH) opprettholdes2 nevnt i begynnelsen.
Strukturelle enheter for tro (OH)2 De er da disse smørbrødene, der lagene til OH- De ville komme til å representere brødene; Negativt lastet brød og som derfor ikke klarer å fikse en slående brun krystall.
Men på den annen side stemmer Hs atomer også og formørkes med hverandre. Disse hydrogenene husker begrepet polaritet og elektronegativitet, og har en svak positiv delvis belastning, Δ+; som, selv om det er svakt, kan ha et positivt område der andre anioner eller molekyler er innlosjert.
Hydrater
Når tro (å)2 Den oppløses i vannet, molekylene koordinerer med metallsenteret for tro2+ Å danne en kompleks acu: [tro (h2ENTEN)4(ÅH)2]. Dette komplekset har en oktaedrisk geometri for å ha seks ligander: fire vannmolekyler og to OH-. I jernhydroksyd er imidlertid panoramaet litt annerledes.
Kan tjene deg: lov om bevaring av materieI hydrat, hypotetisk formel Fe (OH)2· NH2Eller vannmolekyler plasseres nøyaktig mellom de to lagene med hydroksyd; det vil si at de samhandler gjennom dipol-ion-krefter med hvite hydrogener eller kuler. Det er som om to Ohfeoh -kamper ble grepet og vann ble ispedd gruppering av dem: Ohfeoh (h2O) Ohfeah.
Vannmolekyler er veldig dynamiske, og forhindrer hydratpartikler fra å skaffe seg betydelige størrelser og danner følgelig en fast kolloidal eller gelé.
Grønn og rød rust
I hydrater har hydroksydlagene ispedd vannmolekyler; Imidlertid kan de ha andre anioner (allerede nevnt), noe som forårsaker et bredt utvalg av grønne herrbles. De kan også "fange" molekyler så store som DNA, eller medisiner.
Ikke bare kan trosioner være til stede2+, men også tro3+, Produkt av intern oksidasjon forårsaket av ispedd oksygen. Synlig vil det bli observert at grønn rust (U -oksid) begynner å bli rødlig når troens konsentrasjon øker3+.
Egenskaper
 Testrør med jernhydroksyd i vann. Kilde: ChemicalInterest [Public Domain]
Testrør med jernhydroksyd i vann. Kilde: ChemicalInterest [Public Domain] Tro (OH) vises ovenfor2 Utfelling i et testrør. Når det er i rikelig vann, må den komplekse ACU dominere over den nylig nevnte strukturen. Merk at overflaten ser ut som en oransje farge, som et resultat av oksidasjon av troen2+ til tro3+ for oksygenet i luften; Det vil si at dette hydroksidet er et reduserende middel:
Tro2+ Tro3+ + og-
Det fysiske utseendet til denne forbindelsen i sin reneste tilstand er et brunt faststoff:
 Ren jernhydroksyd. Kilde: Ondřej Mangl [Public Domain]
Ren jernhydroksyd. Kilde: Ondřej Mangl [Public Domain] Som, avhengig av dets fuktighetsnivå, kan presenteres som et gelé -grønt fast stoff. Det er ganske uoppløselig i vann (ksp= 8 · 10-16 og løselighet = 0,72 g/100 ml ved 25 ºC), og har en molmasse på 89,86 g/mol og en tetthet på 3,4 g/ml.
Det kan tjene deg: De 20 typene kjemi og deres avviklingIngen kokende eller fusjonspunkt for denne forbindelsen rapporteres; Sannsynligvis på grunn av det faktum at den før en varmekilde blir dehydrert og konverterer til jernholdig oksid, stygt:
Tro (å)2 => Stygg + h2ENTEN
applikasjoner
Organisk kvalitativ analyse
Den reduserende kraften brukes til å bestemme tilstedeværelsen av nitroforbindelser, RNO2. Reaksjonen som en positiv test oppnås for er representert med følgende kjemiske ligning:
Rno2 + 6fe (OH)2 + 4H2O => rnh2 + 6fe (OH)3
Troen (å)3 utfeller som et brunt -redizo -faststoff, som bekrefter tilstedeværelsen av nitro -gruppen, -no2.
Selen fra Oxoanions reduserer
Troens reduserende kraft (OH)2 Det har også brukt til å redusere SEO -anioner32- (selenito) og SEO42- (selenat) til elementær selen,. Praktisk talt tillater det fjerning av slike anioner, helseskadelig, i form av et uoppløselig og lett avtakbart selenfast.
Doble lag materialer
Den rene strukturen, og grønn rust, er en inspirasjonskilde for utforming av nye materialer av mineralogiske egenskaper.
Det anslås at funksjonen til disse er tillater transport av en spesifikk art mellom lagene, på en slik måte at dens frigjøring kan kontrolleres eller reduseres til det aktive stedet (jordsmonn, celler, metalloverflate, etc.).
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Jern (ii) hydroksyd. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2019). Jernholdig hydroksyd. PubChem -database. CID = 10129897. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Nick Doe. (s.F.). Tester for fenoler og nitrogrupper. Kjemi 211. Hentet fra: Akademikere.Wellesley.Edu
- Clark Jim. (27. april 2019). Kjemi av jern. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Kingston teknisk programvare. (2019). Rustkjemi. Korrosjonsleger. Gjenopprettet fra: korrosjonsdotorer.org
- Zingaro, Ralph A. et al. (1997). Reduksjon av oksoseleniumanioner ved jern (II) hydroksyd. Miljø internasjonal. 23 (3): 299-304. Doi: 10.1016/S0160-4120 (97) 00032-9

