Tinnoksid (ii) struktur, egenskaper, nomenklatur, bruk

- 655
- 85
- Prof. Oskar Aas
Han tinnoksid (ii) Det er et krystallinsk uorganisk fast stoff som dannes ved oksidasjon av tinn (SN) av oksygen, der tinn skaffer seg Valencia 2+. Den kjemiske formelen er SNO. To forskjellige måter av denne forbindelsen er kjent på: Det svarte og røde. Den vanlige og mest stabile formen ved romtemperatur er svart eller svartblå modifisering.
Dette skjemaet er utarbeidet ved tinnkloridhydrolyse (II) (SNCL2) I vandig løsning, som ammoniumhydroksyd tilsettes (NH4Å) for å oppnå et hydrert oksydfelling fra Sn (ii) hvis formel er SNO.Xh2Eller, hvor x<1 (x menor que 1).
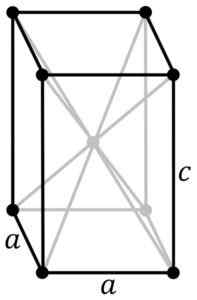 Tetragonal krystallinsk struktur av den svartblå SNO. SN -atomet er lokalisert i midten av strukturen og oksygenatomer i toppunktene til parallellpiped. Original PNGs av bruker: Rocha, sporet i Inkscape av bruker: Stannered [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]] Kilde: Wikipedia Commons
Tetragonal krystallinsk struktur av den svartblå SNO. SN -atomet er lokalisert i midten av strukturen og oksygenatomer i toppunktene til parallellpiped. Original PNGs av bruker: Rocha, sporet i Inkscape av bruker: Stannered [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]] Kilde: Wikipedia Commons Hydrert oksid er et hvitt amorft fast stoff, som deretter blir oppvarmet i suspensjon til 60-70 ºC i flere timer i nærvær av NH4Å, til du får den svarte krystallinske ren sno.
Den røde formen til SNO er metastabil. Det kan fremstilles ved å tilsette fosforsyre (h3Po4) - med 22% fosforsyre, h3Po3 - Og så NH4Å en SNCL -løsning2. Det oppnådde hvite fast stoffet er oppvarmet i samme løsning til 90-100 ºC i omtrent 10 minutter. På denne måten oppnås den rene røde krystallinske Sno.
Tinnoksid (II) er et startmateriale for produksjon av andre tinnforbindelser (II). Av denne grunn er det en av tinnforbindelsene som har en betydelig kommersiell betydning.
Tinnoksid (ii) presenterer lav toksisitet som med de fleste tinn -ororganiske forbindelser. Dette skyldes deres dårlige absorpsjon og rask utskillelse av levende vesener stoffer.
Det kan tjene deg: Bipe Beraral: Hva er, egenskaper, hva er det forPresenterer en av de største toleransene for tinnforbindelser i tester utført med rotter. Imidlertid kan det være skadelig hvis det inhaleres i store mengder.
[TOC]
Struktur
Tinnoksid (ii) svartblå
Denne modifiseringen krystalliserer med tetragonal struktur. Den har et lagordning.
Andre forskere bekrefter at hvert SN -atom er omgitt av 5 oksygenatomer som er omtrent i toppunktene til en oktaedron, der det sjette toppunktet antagelig er okkupert av et par gratis eller ikke sammenkoblede elektroner. Dette er kjent som den φ-oktiske arrangementet.
Rødt tinnoksid (II)
Denne formen for tinnoksyd (ii) krystalliserer med ortorrombisk struktur.
Nomenklatur
- Tinnoksid (ii)
- Estany Oxide
- Tinnmonoksid
- Estany Oxide
Egenskaper
Fysisk tilstand
Krystallinsk fast.
Molekylær vekt
134,71 g/mol.
Smeltepunkt
1080 ºC. Det dekomponerer.
Tetthet
6.45 g/cm3
Løselighet
Uoppløselig i kaldt eller varmt vann. Uoppløselig i metanol, men det løses raskt opp i syrer og konsentrert alkalier.
Andre egenskaper
Hvis mer enn 300 ºC blir oppvarmet i nærvær av luft, oksideres tinnoksidet (II) raskt i tinnoksid (iv) som presenterer glødel.
Det er rapportert at under ikke-oksidantforhold har tinnoksid (II) oppvarming forskjellige resultater i henhold til graden av renhet av startoksydet. Det er generelt uforholdsmessig i metallisk SN og tinnoksid (IV), SNO2, Med forskjellige mellomarter som endelig blir SNO2.
Tinnoksid (II) er amfotero, ettersom det er oppløst i syrer for å gi SN -ioner2+ eller anioner komplekser, og oppløses også i alkalier for å danne hydroksy-stanning-ioneløsninger, SN (OH)3-, som har en pyramidal struktur.
Det kan tjene deg: perklorsyre: formel, egenskaper og brukI tillegg er SNO et reduksjonsmiddel og reagerer raskt med organiske syrer og mineraler.
Det presenterer lav toksisitet hvis sammenlignet med andre tinnsalter. DL50 (50% dødelig dose eller middels dødelig dose) hos rotter er mer enn 10000 mg/kg. Dette betyr at mer enn 10 gram per kilo er påkrevd for å drepe 50% av rotteprøver under en viss prøveperiode. Til sammenligning presenterer tinnfluorid (II) en 188 mg/kg DL50.
Imidlertid, hvis det blir inhalert i lang tid, blir den avsatt i lungene fordi den ikke blir absorbert og kan gi tinn (infiltrasjon av sno -støvet i lunge -mellomtallene).
applikasjoner
I produksjonen av andre tinnforbindelser (ii)
Den raske reaksjonen med syrer er grunnlaget for den viktigste bruken, som er som mellomledd i fremstilling av andre tinnforbindelser.
Det brukes i produksjonen av tinnbromid (II) (SNBR2), Tinn cyanid (ii) (SN (CN)2) og tinnfluoroborathydrat (ii) (SN (BF4)2), Blant andre tinnforbindelser (ii).
Tinnfluoroborat (II) utarbeides ved å løse opp SNAM. Dette skyldes blant annet den høye dekningskapasiteten.
Tinn (ii) oksid brukes også i tinnsulfatpreparat (II) (SNSO4), ved SNO og svovelsyre -reaksjon, h2SW4.
SNSO4 Oppnådd, den brukes i den fortinnede prosessen for produksjon av trykte kretplater, for elektrisk kontaktfinish og for kjøkkenutstyr.
Kan tjene deg: aluminiumkarbonat: struktur, egenskaper, bruk Trykt krets. Ingen maskinlesbar forfatter gitt. Abraham Del Pozo antok (basert på krav om opphavsrett)). [Public Domain] Kilde: Wikimedia Commons
Trykt krets. Ingen maskinlesbar forfatter gitt. Abraham Del Pozo antok (basert på krav om opphavsrett)). [Public Domain] Kilde: Wikimedia Commons Den hydratiserte formen av SNO, Tin Hydrotado (II) SNO.Xh2Eller, den blir behandlet med fluorhorhoric acid for å oppnå tinnfluorid (II), SNF2, som legges til Dentifric Creams som et middel for å bekjempe karies.
I smykker
Tinnoksid (II) brukes til fremstilling av gullstrekk og kobber-stubs krystaller. Tilsynelatende er dens funksjon i denne applikasjonen å fungere som et reduserende middel.
 Juvel med rubin. Kilde: Pixabay
Juvel med rubin. Kilde: Pixabay Andre bruksområder
Det har blitt brukt i solcelleanordninger for produksjon av elektrisitet fra lys, for eksempel solceller.
 Fotovoltaisk enhet. Georg Slickers [CC BY-SA 2.5 (https: // creativecommons.Org/lisenser/by-SA/2.5)] Kilde: Wikipedia Commons
Fotovoltaisk enhet. Georg Slickers [CC BY-SA 2.5 (https: // creativecommons.Org/lisenser/by-SA/2.5)] Kilde: Wikipedia Commons Nyere innovasjoner
Sno-bestilte nanopartikler har blitt brukt i karbon nanorørelektroder for litiumsukkerbatterier.
 Sno hydrat nanofibre. Fionán [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Kilde: Wikipedia Commons
Sno hydrat nanofibre. Fionán [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Kilde: Wikipedia Commons SNO -forberedte elektroder viser høy konduktivitet og liten volumendring i repeterende belastning og nedlastingssykluser.
I tillegg letter SNO en rask ion/elektronoverføring under oksidasjonsreduksjonsreaksjoner som oppstår i slikt batterisystem.
Referanser
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Dans, j.C.; Emeléus, h.J.; Sir Ronald Nyholm og Trotman-Deckenson, til.F. (1973). Omfattende uorganisk kjemi. Volum 2. Pergamon Press.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte utgave. Volum A27. VCH Verlagsgellschaft MBH.
- Kirk-Ohmer (1994). Encyclopedia of Chemical Technology. Volum 24. Fjerde utgave. John Wiley & Sons.
- Ostrakhovitch, Elena til. Og Cherian, m. George. (2007). Tinn. I håndboken om metallers toksikologi. Tredje utgave. Gjenopprettet fra Scientedirect.com.
- Kwestroo, w. og Vromans, P.H.G.M. (1967). Forberedelse av tre modifikasjoner av ren tinn (ii) oksid. J. Inorg. NUKL. Chem., 1967, vol.29, s.2187-2190.
- Foud, s.S et al. (1992). Optiske egenskaper til stannøse oksydtynne filmer. Tsjekkoslovak Journal of Physics. Februar 1992, bind 42, utgave 2. Gjenopprettet fra Springer.com.
- A-young Kim et al. (2017). Bestilte SNO-nanopartikler i MWCNT som et funksjonelt vertsmateriale for høyrate litium-svovelbatterikatode. Nano Research 2017, 10 (6). Gjenopprettet fra Springer.com.
- National Library of Medicine. (2019). Stannøs oksid. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov

