Litiumoksid
- 1312
- 2
- Prof. Oskar Aas
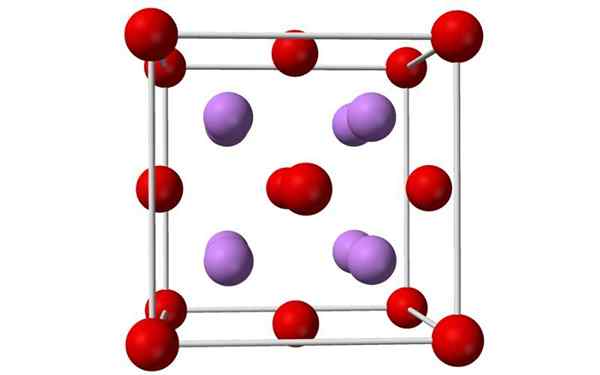
 Kuler og barer modell av en enhetlig litiumoksydcelle. Kilde: Benjah-BMM27, Wikimedia Commons
Kuler og barer modell av en enhetlig litiumoksydcelle. Kilde: Benjah-BMM27, Wikimedia Commons Hva er litiumoksid?
Han Litiumoksid Det er en uorganisk kjemisk forbindelse av formel li2Eller det dannes sammen med små mengder litiumperoksyd når litiummetallet brennes i luften og kombineres med oksygen.
Fram til 90 -tallet ble metall- og litiummarkedet dominert av amerikansk produksjon fra mineralforekomster, men på begynnelsen av det 21. århundre var det meste av produksjon. Bolivia har halvparten av litiumforekomster i verden, men det er ikke en god produsent.
Den viktigste kommersielle formen er litiumkarbonat, li2Co3, produsert fra mineraler eller salmuelas av flere forskjellige prosesser.
Når litium brenner i luften, er hovedproduktet hvitt litiumoksydoksid, Li2ENTEN. I tillegg oppstår noe litiumperoksyd, Li2ENTEN2, Også hvit.
Det kan også gjøres gjennom termisk nedbrytning av litiumhydroksyd, LIOH eller litiumperoksyd, Li2ENTEN2.
4LI (S) + O2(g) → 2li2Du)
2Lioh (S) + varme → Li2Eller (s) + h₂o (g)
2li2ENTEN2(S) + varme → 2LI2Eller (er) + eller2(g)
Fysiske og kjemiske egenskaper
- Litiumoksid er et hvitt fast stoff kjent som litia, som mangler aroma og har salt smak.
- Litiumoksyd er krystaller med antiflorittgeometri, lik natriumklorid (kubikk sentrert på ansikter).
- Molekylvekten er 29,88 g/mol, tettheten er 2.013 g/ml og fusjons- og kokepunktene er henholdsvis 1438 ° C og 2066 ° C.
Det kan tjene deg: EPID- Forbindelsen er veldig løselig i vann, alkohol, eter, pyridin og nitrobenzen.
- Litiumoksid reagerer lett med vanndamp for å danne hydroksyd, og karbondioksid for å danne karbonat; Derfor må den lagres og administreres i en ren og tørr atmosfære.
- Oksidforbindelser utfører ikke strøm. Imidlertid er visse strukturerte oksider av perovskita elektronisk ledende som finner anvendelse i den faste oksidbrenselcellekatoden og oksygenproduksjonssystemer.
- De er forbindelser som inneholder minst en oksygenanion og en metallisk kation.
Risiko
Litiumoksid er en stabil forbindelse som er uforenlig med sterke syrer, vann og karbondioksid. Så vidt vi vet, er de kjemiske, fysiske og toksikologiske egenskapene til litiumoksyd ikke blitt undersøkt og rapportert grundig.
Toksisiteten til litiumforbindelser er en funksjon av deres løselighet i vann. Litiumionet har toksisitet i sentralnervesystemet. Forbindelsen er svært etsende, irriterende hvis den kommer i kontakt med øynene og huden, når den er inhalert eller inntatt.
I tilfelle øyekontakt, må du bekrefte om kontaktlinser brukes og fjerne dem umiddelbart. De må skylles med rennende vann i minst 15 minutter, og holde øyelokkene åpne. Kaldt vann kan brukes, og ikke et øyesalve.
Hvis kjemikaliet kommer i kontakt med klærne, beholder det så raskt som mulig, og beskytter egne hender og kropp. Plasser offeret under en sikkerhetsdusj.
Hvis kjemikaliet akkumuleres i offerets utsatte hud, for eksempel hendene, vaskes huden forurenset med rennende vann og ikke -slimete såpe mykt og forsiktig. Kaldt vann kan brukes. Hvis irritasjon vedvarer, må du søke lege. Vask forurensede klær før du bruker det igjen.
Kan tjene deg: Rankine Scale: Hva er, konverteringer, eksemplerI tilfelle innånding, bør offeret få lov til å stå i et godt ventilert område. Hvis innånding er alvorlig, må offeret evakueres til et trygt område så snart som mulig.
Løsne tette klær, for eksempel skjortehals, belter eller slips. Hvis offeret er vanskelig å puste, må oksygen administreres. Hvis offeret ikke puster, blir det laget en gjenopplivning av munnen.
Når du alltid tar i betraktning at det kan være farlig for personen som gir hjelp til å gi munn til munnen gjenopplivning når det inhalerte materialet er giftig, smittsomt eller etsende. I alle tilfeller bør det søkes øyeblikkelig legehjelp.
applikasjoner
- Litiumoksid brukes som grunnlegger i keramiske emaljer, og skaper blå med kobber og roser med kobolt. Reagerer med vann og damp, danner litiumhydroksid og bør isoleres fra dem.
- Litiumoksid (li2O), med sitt høye Tritio -potensial, er det en attraktiv kandidat for det faste dyrkningsmaterialet til et DT -fusjonsenergiplante, på grunn av dets høye tetthet av litiumatomer (sammenlignet med annet litium eller metallisk litiumkeramikk) og dens relativt høye varmeledningsevne.
Li2O Det vil bli utsatt for høye temperaturer under nøytronbestråling under drift av fusjonstepper. Under disse omstendighetene vil et stort antall bestrålingsdefekter bli produsert i Li2Eller, for eksempel heliumindusert hevelse, relativt høy termisk ekspansjon, kornvekst, LYH (T) dannelse og nedbør ved lave temperaturer og transport av LIOH (T) masse ved høye temperaturer.
I tillegg li2Eller vil bli utsatt for spenninger som oppstår fra termiske ekspansjonsforskjeller mellom Li2O og strukturelle materialer. Disse egenskapene til Li2Eller føre til utfordrende ingeniørproblemer både i produksjon og mantedesign.
Kan tjene deg: Strontium Hydride (SRH2)- En mulig ny bruk er som en erstatning for kobolt- og litiumoksyd, for eksempel katode i litium -ion -batterier som brukes til å øke elektroniske mobiltelefonenheter til bærbare datamaskiner, samt biler med batterier.
Referanser
- Amerikanske elementer. Litiumoksid. Gjenopprettet fra amerikanementer som amerikanementer.com.
- Litiumoksid. Utvunnet fra espimetals espimetaler.com.
- Litiumoksid (Li2O). Ferpen kom seg.UCSD.Edu Ferp.UCSD.Edu.

