Silisiumoksyd (SiO2) struktur, egenskaper, bruksområder

- 1910
- 382
- Markus Fredriksen
Han silisiumoksid Det er et uorganisk fast stoff dannet av foreningen av et silisiumatom og to oksygen. Den kjemiske formelen er Sio2. Denne naturlige forbindelsen kalles også silisium eller silisiumdioksid.
Sio2 Det er det mest tallrike mineralet i jordskorpen, siden sanden er sammensatt av silika. I henhold til strukturen kan silika være krystallinsk eller amorf. Det er uoppløselig i vann, men oppløses i alkalier og i fluorhorinsyre HF.
 Sanden er en kilde til silisiumdioksid sio2. ರವಿಮುಂ [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Sanden er en kilde til silisiumdioksid sio2. ರವಿಮುಂ [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. Sio2 Det er også til stede i strukturen til visse planter, bakterier og sopp. Også i skjeletter av marine organismer. I tillegg til sanden, er det også andre typer steiner som er silika.
Silika har en veldig utbredt bruk som oppfyller en rekke funksjoner. Den mest utbredte bruken er som filtreringsmateriale av væsker som oljer og oljeprodukter, drikke som øl og vin, samt fruktjuicer.
Men det har mange andre applikasjoner. Noe av de mest nyttige og viktige er i produksjonen av bioaktivt glass, som tillater "stillas" der beinceller vokser for å produsere manglende beindeler på grunn av ulykke eller sykdom.
[TOC]
Struktur
Silicio SiO -dioksid2 Det er et tre -atommolekyl, der silisiumatomet er knyttet til to oksygenatomer med kovalente bindinger.
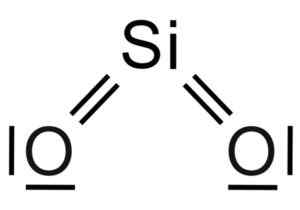 Kjemisk struktur av SIO -molekylet2. Grasso Luigi [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Kjemisk struktur av SIO -molekylet2. Grasso Luigi [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. Den strukturelle enheten av fast silika som sådan er et tetrahedron der et silisiumatom er omgitt av 4 oksygenatomer.
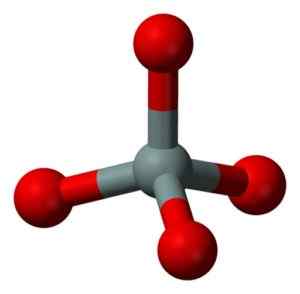 Strukturell enhet av fast silika: grå = silisium, rød = oksygen. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons.
Strukturell enhet av fast silika: grå = silisium, rød = oksygen. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons. Tetrahedra binder seg til hverandre som deler oksygenatomene i deres sammenhengende toppunkter.
Det er grunnen til at et silisiumatom deler i halvparten av hvert av de 4 oksygenatomene, og dette forklarer forholdet i forbindelsen til 1 silisiumatom ved 2 oksygenatomer (SIO2).
 Tetrahedra deler oksygen i SiO2. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons.
Tetrahedra deler oksygen i SiO2. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons. SIO -forbindelser2 De er delt inn i to grupper: krystallinsk silika og amorf silika.
Krystallinske silisiumdioksydde har strukturer med repeterende mønstre av silisium og oksygen.
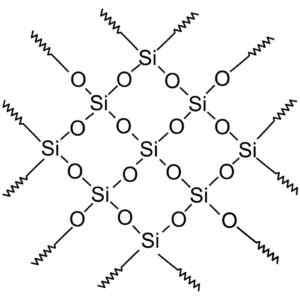 Krystallinsk silika har repeterende enheter. Wersję rastrową wykonał użytkownik polskiego projektu wikipedii: polyimerek, zwektoryzował: krzysztof zajączkowski [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Kilde: Wikimedia Commons.
Krystallinsk silika har repeterende enheter. Wersję rastrową wykonał użytkownik polskiego projektu wikipedii: polyimerek, zwektoryzował: krzysztof zajączkowski [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Kilde: Wikimedia Commons. All silikakrystall kan betraktes som et gigantisk molekyl der det krystallinske nettverket er veldig sterkt. Tetrahedra kan knyttes på forskjellige måter, og gi opphav til forskjellige krystallinske former.
Kan tjene deg: Bravais nettverk: konsept, egenskaper, eksempler, øvelserI amorf silika er strukturene tilfeldig koblet sammen, uten å følge et vanlig mønster mellom molekylene, og disse er i et annet romlig forhold til hverandre.
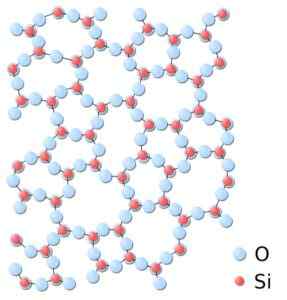 I amorf silika er fagforeninger ikke repeterende eller ensartet. Silika.SVG: *silika.JPG: I: Bruker: JDrewittderIVEvativt arbeid: Matt [Public Domain]. Kilde: Wikimedia Commons.
I amorf silika er fagforeninger ikke repeterende eller ensartet. Silika.SVG: *silika.JPG: I: Bruker: JDrewittderIVEvativt arbeid: Matt [Public Domain]. Kilde: Wikimedia Commons. Nomenklatur
-Silisiumoksid
-Silisiumdioksid
-Silika
-Kvarts
-Tridimita
-Cristobalita
-Dioxosilano
Egenskaper
Fysisk tilstand
Farge fargeløs til grå.
 Sio prøve2 ren. LHCHEM [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Sio prøve2 ren. LHCHEM [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Molekylær vekt
60,084 g/mol
Smeltepunkt
1713 ºC
Kokepunkt
2230 ºC
Tetthet
2,17-2,32 g/cm3
Løselighet
Uoppløselig i vann. Amorf silika er løselig i alkalier, spesielt hvis den er fint delt. Løselig i fluorhorsyre HF.
Amorf silika er mindre hydrofil, det vil si mindre relatert til vann enn den krystallinske.
Kjemiske egenskaper
Sio2 o silika er i hovedsak inert for de fleste stoffer, det er veldig lite reaktivt.
Motstår angrepet av klor CL2, Bromo Br2, Hydrogen H2 og av de fleste syrer ved romtemperatur eller litt høyere. Blir angrepet av fluor f2, HF fluorhorsyre og alkalier som natriumkarbonat2Co3.
Sio2 Det kan kombineres med metallelementer og oksider for å danne silikater. Hvis silika smelter med alkaliske metallkarbonater ved omtrent 1300 ° C, oppnås alkaliske silikater og CO2.
Det er ikke drivstoff. Det har lav varmeledningsevne.
Tilstedeværelse i naturen
Den viktigste silikakilden i naturen er sand.
Sio2 O Silica er i form av tre krystallinske varianter: kvarts (den mest stabile), Tridimita og Cristobalita. Amorfant for silika er agata, jasse og Ónice. Opalen er en amorf hydrert silika.
Det er også den så -kallede biogene silikaen, det vil si den som genereres av levende organismer. Kilder til denne typen silika er bakterier, sopp, diatomer, havsvamper og planter.
De lyse og harde delene av bambus og halmen inneholder silika, og skjelettene til noen marine organismer har også en stor andel silika; Imidlertid er de viktigste diatomatorene.
Diatoma -land er geologiske produkter av forfallede encellede organismer (alger).
Kan tjene deg: kosmisk støvAndre typer naturlig silika
I naturen er det også følgende varianter:
- Vitratisk silikaner som er vulkansk glass
- Milleritasene som er naturlig glass produsert av fusjon av silitisk materiale under påvirkning av meteoritter
- Den smeltede silikaen som er oppvarmet silika til væsken og avkjølt fase uten å tillate en krystallisk
Å skaffe
Silika fra arenaer er hentet direkte fra steinbruddene.
 Arena steinbrudd i California. Ruff Tux Cream Puff [CC0]. Kilde: Wikimedia Commons.
Arena steinbrudd i California. Ruff Tux Cream Puff [CC0]. Kilde: Wikimedia Commons. Diatomitten eller diatomene oppnås også på denne måten, ved bruk av lignende gravemaskiner og utstyr.
Amorf silika tilberedes basert på vandige alkaliske metallsilikatløsninger (for eksempel natrium Na) ved nøytralisering med syre, så som svovelsyre H2SW4, HCl saltsyre eller karbondioksid2.
Hvis den endelige pH i løsningen er nøytral eller alkalisk, oppnås utfelt silika. Hvis pH er syre, oppnås gel -silika.
Pyrogen silika fremstilles ved forbrenning av en flyktig silisiumforbindelse, vanligvis silisiumsikl tetraklorid4. Den utfelte silikaen oppnås fra en vandig løsning av silikater som syre tilsettes.
Kolloidal silika er en stabil spredning av amorfe silika kolloidale partikler i en vandig løsning.
applikasjoner
I flere applikasjoner
Silika eller sio2 Den har et bredt utvalg av funksjoner, for eksempel fungerer det som slitende, absorberende, antiapelmazante, utstoppet, opacifying og for å favorisere suspensjon av andre stoffer, blant mange andre arbeidsmåter.
Det brukes for eksempel:
-I glass, keramikk, ildfast, slitende og løselig glassproduksjon
-Misfarisering og rensing av oljer og oljeprodukter
-I muggsopp for støperi
-Som antiapelmazante av pulver av alle slag
-Som antispumant
-For å filtrere væsker som tørrvaskemidler, vannet i bassengene og kommunalt og industrielt avløpsvann
-I fremstilling av varmeisolatorer, brannsikre murstein og emballasjematerialer som er motstandsdyktige mot brann og syrer
-Som å fylle ut fremstilling av papirer og kort, for å gjøre dem mer motstandsdyktige
-Som fylt med malerier for å forbedre strømmen og fargen
-I materialer for metallpolering og tre, da de gir dem slimvhet
-I kjemiske analyselaboratorier i kromatografi og som absorberende
-Som antiapelmazante av insektmiddel og agrokjemiske formler, for å hjelpe til
-Som katalysatorstøtte
-Som fylling for å forsterke syntetisk gummi og gummi
Kan tjene deg: langsgående bølger: egenskaper, forskjeller, eksempler-Som en bærer av væsker i dyremat
-I trykkblekk
-Som tørkemiddel og adsorbent, i form av silikagel
-Som tilsetningsstoff i sement
-Som kjæledyrsand
-I mikroelektroniske isolatorer
-I termoptiske brytere
 Silisiumkrem. Kenpei [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]. Kilde: Wikimedia Commons.
Silisiumkrem. Kenpei [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]. Kilde: Wikimedia Commons. I matindustrien
En amorf silika er integrert i en rekke matvarer som en multifunksjonell direkte ingrediens i forskjellige typer mat. Du skal ikke overstige 2% av den ferdige maten.
For eksempel fungerer det som Antiapelmazante (for å forhindre at visse matvarer holder seg), som en stabilisator i produksjonen av øl, som en antiprecipitator, for å filtrere vin, øl og fruktjuice eller grønnsaker.
 Team for vinfiltrering med diatomer (Sio2). Fabio Ingroso [CC av 2.0 (https: // creativecommons.Org/lisenser/av/2.0)]. Kilde: Wikimedia Commons.
Team for vinfiltrering med diatomer (Sio2). Fabio Ingroso [CC av 2.0 (https: // creativecommons.Org/lisenser/av/2.0)]. Kilde: Wikimedia Commons. Det fungerer som en flytende absorberende i noen matvarer og komponent av mikrokapsler for smaksoljer.
I tillegg SIO2 amorf brukes gjennom en spesiell prosess på overflaten av plasten til artikler for å pakke mat, og fungerer som en barriere.
I legemiddelindustrien
Det tilsettes som et antiapelmazante middel, tykning, gelering og som en hjelpestoff, det vil si som assistent for å forme flere medisiner og vitaminer.
I kosmetikkindustrien og personlig pleie
Det brukes i en rekke produkter: i ansiktspulver, øyenskygger, øyelyinere, leppestifter, fargelegging, sminkehjul, talkos, føtterpulver, hårfargestoffer og blekemiddel og blekemiddel.
Også i oljer og badesalt, skumbad, hender og kroppskrem.
Også i natthydreringskremer, lysstyrke og neglermaling.
I terapeutiske anvendelser
Sio2 Det er til stede i bioaktivt eller biovidrios glass hvis hovedkarakteristikk er at de kan reagere kjemisk med det biologiske miljøet som omgir dem, og danner en sterk og holdbar kobling med det levende vevet.
Denne typen materiale tjener til å lage beinstatninger som ansiktet, for eksempel "stillas" der beinceller vil vokse. De har vist god biokompatibilitet med både bein og mykt vev.
Disse biovidriosene vil tillate å gjenvinne bein fra ansiktet til mennesker som har mistet dem ved en tilfeldighet eller sykdom.
Risiko
Veldig tynne silikapartikler kan suspenderes i luften og danne ikke -eksplosive pulver. Men dette støvet kan irritere huden og øynene. Innånding forårsaker irritasjon i luftveiene.
I tillegg produserer innånding av silisiumsøvler langvarig skade på lungene, kalt silikose.
Referanser
- ELLER.S. National Library of Medicine. (2019). Silisiumdioksid. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Da silva, m.R. et al. (2017). Grønne ekstraksjonsteknikker. Silikabaserte sorbnts. I forståelse av analytisk kjemi. Gjenopprettet fra Scientedirect.com.
- Ylänen, h. (redaktør). (2018). Bioaktive briller: materialer, egenskaper og applikasjoner (andre utgave). Elsevier. Gjenopprettet fra bøker.Google.co.gå.
- WINDHOLZ, m. et al. (redaktører) (1983) Merck -indeksen. Et leksikon av kjemikalier, drarugs og biologiske. Tiende utgave. Merck & co., Inc.
- Mäkinen, J. Og Suni, t. (2015). Tykkfilm soi wafers. I Handbook of Silicon Based Mems Materials and Technologies (Second Edition). Gjenopprettet fra Scientedirect.com.
- Sirleto, l. et al. (2010). Termo-optiske brytere. Silisium nanokrystaller. Gjenopprettet fra Scientedirect.com.

