Kalsiumfluorid (CAF2) struktur, egenskaper, bruk

- 2419
- 535
- Jonathan Carlsen
Han Kalsiumfluorid Det er et uorganisk fast stoff dannet av et kalsiumatom (Ca) og to fluoratomer (F). Den kjemiske formelen er CAF2 Og det er et krystallinsk grått -hvitt fast stoff.
I naturen finnes det i fluormalmen eller sprutfluor. Det eksisterer naturlig i bein og tenner. Fluor mineral er den viktigste kilden som brukes til å oppnå andre fluorforbindelser.
 Caf kalsiumfluorid2 fast. W: Bruker: Walkerma i juni 2005. Kilde: Wikimedia Commons.
Caf kalsiumfluorid2 fast. W: Bruker: Walkerma i juni 2005. Kilde: Wikimedia Commons. I tillegg kaffen2 Det brukes til kariesforebygging i tennene, så det legges til materialer som brukes av tannleger for å kurere dem. Faktisk tilsettes også kalsiumfluorid til drikkevann (vann som kan full.
Caf2 Det brukes i store krystaller i optisk utstyr og kameraer. Det brukes også i små enheter som tjener til å oppdage hvor mye en person har blitt utsatt for radioaktivitet.
[TOC]
Struktur
Caf kalsiumfluorid2 Det er en ionisk forbindelse dannet av en Ca -kalsiumkation2+ og to fluor f aniteter-. Noen informasjonskilder indikerer imidlertid at koblingene deres har en viss kovalent karakter.
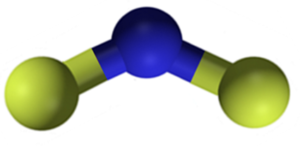 Caf kalsiumfluoridstruktur2. Blå: kalsium; Gul fluor. Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Caf kalsiumfluoridstruktur2. Blå: kalsium; Gul fluor. Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. Nomenklatur
Kalsiumfluorid
Egenskaper
Fysisk tilstand
Fargelegging fast til gråaktig hvit med kubikk krystallinsk struktur.
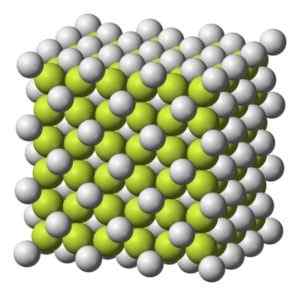 Kubikk krystallinsk struktur av kaffe2. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons.
Kubikk krystallinsk struktur av kaffe2. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons. Molekylær vekt
78,07 g/mol
Smeltepunkt
1418 ºC
Kokepunkt
2533 ºC
Tetthet
3.18 g/cm3 ved 20 ° C.
Brytningsindeks
1.4328
Løselighet
Det er uoppløselig i vann ved 20 ° C. Nesten uoppløselig ved 25 ° C: 0,002 g/100 ml vann. Litt sur løselig.
Kjemiske egenskaper
Dets oksiderende eller reduserende egenskaper er veldig svake, men disse reaksjonene kan oppstå. Skjønt, vanligvis, i veldig få tilfeller.
Det er inert til organiske kjemiske forbindelser og mange syrer, inkludert HF -fluorhorinsyre. Det oppløses sakte i salpetersyre3.
Kan tjene deg: Millikan Eksperiment: Prosedyre, forklaring, betydningDet er ikke brannfarlig. Reagerer ikke raskt med luft eller vann.
På grunn av sin lille affinitet til vann, selv om det er utsatt for en høy prosentandel av fuktighet, påvirker det ikke den selv i en måned ved normal romtemperatur.
I nærvær av fuktighet oppløses veggene i krystaller sakte ved temperaturer over 600 ° C. I tørre miljøer kan det brukes opp til omtrent 1000 ° C uten betydelig påvirket.
Tilstedeværelse i naturen
Caf kalsiumfluorid2 Det finnes naturlig i fluormalm eller sprutfluorid.
Selv om kaffen2 Rent er fargeløs, fluorittmineral blir ofte farget av tilstedeværelsen av elektroner fanget i "hullene" i den krystallinske strukturen.
Dette mineralet er høyt verdsatt for sin glassaktig lysstyrke og forskjellige farger (lilla, blå, grønn, gul, fargeløs, brun, rosa, svart og rødoransje). Det sies å være "det mest fargede mineralet i verden".
 Fluor av en gruve i Frankrike. Toulouse Muséum [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Fluor av en gruve i Frankrike. Toulouse Muséum [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Fluoritt (blå krystaller) av Natural Museum of Milano. Giovanni Dall'orto [CC By-SA 2.5 IT (https: // creativecommons.Org/lisenser/by-SA/2.5/it/gjerning.i)]. Kilde: Wikimedia Commons.
Fluoritt (blå krystaller) av Natural Museum of Milano. Giovanni Dall'orto [CC By-SA 2.5 IT (https: // creativecommons.Org/lisenser/by-SA/2.5/it/gjerning.i)]. Kilde: Wikimedia Commons. Fluoritt av en gruve i England. Didier Descuens [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Fluoritt av en gruve i England. Didier Descuens [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. Fluor av en gruve i Frankrike. Didier Descuens [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Fluor av en gruve i Frankrike. Didier Descuens [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
 Fluor av en gruve i USA. Forfatter: Oliveira Jurema. Kilde: Wikimedia Commons.
Fluor av en gruve i USA. Forfatter: Oliveira Jurema. Kilde: Wikimedia Commons. Kalsiumfluor er også funnet i bein i mengder mellom 0,2 og 0,65%, og også i tennens emalje i 0,33-0,59%.
applikasjoner
- Ved å oppnå fluorforbindelser
Fluorita Caf2 Det er den grunnleggende eller majoritetskilden til fluor over hele verden. Det er råstoffet for å fremstille nesten alle fluorforbindelser.
Den viktigste av disse er HF -fluorhorsyre, hvorfra de andre fluktforbindelsene er fremstilt. Fluorionet f- Det frigjøres fra mineralet ved reaksjon av dette med konsentrert svovelsyre H2SW4:
Kan tjene deg: IsomeriaCaf2 (solid) + H2SW4 (væske) → sak4 (fast) + 2 HF (gass)
- I tenner
Caf kalsiumfluorid2 Det er en agent for forebygging av karies. Det brukes til å fluorisere drikkbart vann (vann som kan være drikke) med det målet.
I tillegg er de lave fluorkonsentrasjonene f- (i størrelsesorden 0,1 deler per million) som brukes i dentifriske pastaer og munnskyll har vist å ha en dyp positiv effekt på den forebyggende tannpleien av karies.
 Kalsiumfluor hjelper med forebygging av karies. Forfatter: Annalize Batista. Kilde: Pixabay.
Kalsiumfluor hjelper med forebygging av karies. Forfatter: Annalize Batista. Kilde: Pixabay. CAF nanopartikler2 mer effektiv
Selv om fluorider brukes i tannpastaer og skyllinger, fører den lave konsentrasjonen av kalsium (Ca) i spytt2 i tennene på en mest mulig effektiv måte.
Det er grunnen til at det er utviklet en måte å skaffe kaffestøv2 som nanopartikler.
For dette brukes en tørketrommel av Rocío (fra engelsk Spray-Dryer) Hvor to løsninger (en av CA (OH) kalsiumhydroksid2 og en av ammoniumfluorid NH4F) De blandes mens de blir sprayet i et kamera med varm luftstrøm.
Da oppstår følgende reaksjon:
CA (OH)2 + NH4F → Caf2 (solid) + NH4Åh
NH4Oh flyktige som NH3 og h2O og CAF -nanopartiklene gjenstår2.
Disse har høy reaktivitet og større løselighet, noe som gjør dem mer effektive for seineralisering av tenner og som antikarier.
- I objektiv for optisk utstyr
Kalsiumfluor brukes til å bygge optiske elementer som prismer og spektrofotometre av infrarød og ultrafiolett lys (UV).
Disse enhetene tillater å måle mengden lys som absorberes av et materiale når det går gjennom det.
Caf2 Det er gjennomsiktig i disse regionene av spekteret av lys, har en ekstremt lav brytningsindeks og gjør det mulig å oppnå en mer effektiv oppløsning enn NaCl i intervallet 1500-4000 cm-1.
Kan tjene deg: paramagnetismeTakket være den kjemiske stabiliteten kan støtte ugunstige forhold slik at de optiske elementene i CAF2 De blir ikke angrepet. Det har også stor hardhet.
I kameraer
Noen kameraprodusenter bruker kaffelinser2 Kunstig krystallisert for å redusere lysdispersjon og oppnå utmerket korreksjon av farger forvrengning.
 Noen kameraer har CAF -kalsiumfluorlinser2 For å redusere fargene forvrengning. Bill Ebbesen [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]. Kilde: Wikimedia Commons.
Noen kameraer har CAF -kalsiumfluorlinser2 For å redusere fargene forvrengning. Bill Ebbesen [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]. Kilde: Wikimedia Commons. - I den metallurgiske industrien
Caf2 Det brukes som et grunnleggende middel i metallurgisk industri, fordi det er en kilde til kalsium uoppløselig i vann og derfor effektivt i oksygenfølsomme anvendelser.
Det brukes til å smelte og behandle jern og stål. Dette er basert på det faktum at det har et smeltepunkt som ligner på jern og også at det kan oppløse oksider og metaller.
- I radioaktivitetsdetektorer eller farlig stråling
Caf2 Det er et termoluminescerende materiale. Dette betyr at den kan absorbere stråling i elektronene i dens krystallinske struktur, og når den blir oppvarmet for å frigjøre den i form av lys.
Dette utsendte lyset kan måles med et elektrisk signal. Dette signalet er proporsjonalt med mengden stråling mottatt av materialet. Betyr at jo større mengde stråling, jo større er lysmengden som vil bli avgitt senere når den blir oppvarmet.
Derfor CAF2 Det brukes i de såkalte personlige toimeter, som brukes av personer som er utsatt for farlig stråling, og du vil vite hvor mye stråling de har fått i løpet av en periode.
- Andre bruksområder
- Det brukes som en katalysator i kjemiske reaksjoner av dehydrering og dehydrogenering for syntese av organiske forbindelser.
- Det brukes i alkaliske elektroder av sveising. En sterkere sveising oppnås enn med syreelektroder. Disse elektrodene er nyttige i fremstilling av skip og stålbeholdere med høyt trykk stål.
- Som mattilskudd i ekstremt lave mengder (ppm eller deler per million).
 Mann sveising. Elektroder med kalsiumfluoridkaffe2 De danner sterkere sveiser. William m. Plate jr. [Offentlig domene]. Kilde: Wikimedia Commons.
Mann sveising. Elektroder med kalsiumfluoridkaffe2 De danner sterkere sveiser. William m. Plate jr. [Offentlig domene]. Kilde: Wikimedia Commons. Referanser
- Pirmradian, m. og Hooshmand, t. (2019). Remineralisering og antibakterielle evner til harpiksbaserte tann nanokompositter. Syntese og karakterisering av kalsiumfluorid (CAF2). I anvendelser av nanokomposittmaterialer i tannbehandling. Gjenopprettet fra Scientedirect.com.
- ELLER.S. National Library of Medicine. (2019). Fluor kalsium. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Weman, k. (2012). Metallbuehåndbok (MMA) sveising med belagte elektroder. I Welding Processes Handbook (Second Edition). Gjenopprettet fra Scientedirect.com.
- Hanning, m. og Hanning, C. (2013). Nanobiomaterialer i forebyggende tannbehandling. Nanosisert fluorkalsium. I nanobiomaterialer i klinisk tannbehandling. Gjenopprettet fra Scientedirect.com.
- Ropp, r.C. (2013). Gruppe 17 (H, F, CL, BR, I) Alkaliske jordforbindelser. Fluor kalsium. I leksikon av de alkaliske jordforbindelsene. Gjenopprettet fra Scientedirect.com.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Valkovic, v. (2000). Målinger av radioaktivitet. I radioaktivitet i miljøet. Themoluminescerende detektorer (TLD). Gjenopprettet fra Scientedirect.com.
- « Nitruro de Boro (BN) struktur, egenskaper, innhenting, bruk
- Silisiumoksyd (SiO2) struktur, egenskaper, bruksområder »

