Ikke -metalliske oksider

- 3858
- 435
- Theodor Anders Hopland
 Karbondioksid er en klimagass og er også et ikke -metallisk oksyd
Karbondioksid er en klimagass og er også et ikke -metallisk oksyd Hva er ikke -metalliske oksider?
De Ikke -metalliske oksider De er binære forbindelser dannet mellom en ikke -metall med positiv oksidasjonstilstand og oksygen med oksidasjonstilstand -2. Disse forbindelsene har også kalt anhydrider og syreoksider.
Ikke -metalliske oksider er veldig vanlig. Faktisk er de overalt. Vann, den vitale væsken som dekker to tredjedeler av jordoverflaten, er en ikke -metallisk oksyd. Så er karbondioksid som vi puster ut under pusten og svoveloksydene som forurenser luft og som forårsaker surt regn.
Når du blir dannet av ikke -metaller og oksygen (som også er en ikke -metall), er koblingene som forener atomene deres kovalente bindinger, i de fleste polare tilfeller. Av denne grunn har det store flertallet av ikke -metalliske eller anhydridoksider betydelig lave kokepunkter, og mange av dem er gasser ved romtemperatur.
Ikke -metalliske oksydegenskaper
- De har ingen glans eller metallisk glans.
- De kan ha forskjellige farger.
- Atomene deres er forent ved hjelp av kovalente bindinger i stedet for ioniske koblinger.
- De er dannet av oksygen og en ikke -metall.
- Sammenlignet med metalloksider, har de vanligvis lave smelte- og kokepunkter, selv om de er veldig mangfoldige.
- De fleste er gasser, men kan også finnes i fast tilstand (for eksempel n2ENTEN3) eller væske ved romtemperatur.
- Solide ikke -metalliske oksider er vanligvis sprø og kan ha forskjellig hardhet.
- De er dårlige ledere av varme og strøm.
- Når de løser dem opp i vann, reagerer de på å danne oksacidsyrer.
- Noen av oksacidsyrene er sterke syrer som har en tendens til å danne anioner eller oksyanioner i vandig løsning.
- De reagerer med grunnleggende oksider for å danne oksisalsalter.
Typer ikke -metalliske oksider
Det er ingen formell eller universelt akseptert klassifisering av ikke -metalliske oksider. Imidlertid kan disse grupperes i henhold til deres syre-baseegenskaper.
Selv om ikke -metalliske oksider også kalles syreoksider, reagerer ikke alle av dem som syrer mot andre forbindelser. I lys av dette kan tre forskjellige typer ikke -metalliske oksider identifiseres i henhold til deres syre/baseegenskaper:
Ikke -metallsyreoksider
De er de vanligste. De aller fleste forbindelser mellom oksygen og en annen ikke -metall, uavhengig av deres oksidasjonsstatus, produserer mineralsyrer når du løser dem opp i vann, noe som gir opphav til syreoppløsninger.
- Noen eksempler på syreoksider er nitrogenanhydrid (n2ENTEN5) og svovelanhydridet (så3).
Nøytrale ikke -metalliske oksider
Noen ikke -metalliske oksider reagerer ikke med vann i det hele tatt når du løses opp i den. I disse tilfellene er den resulterende løsningen nøytral (den er verken sur eller grunnleggende).
- Noen eksempler på nøytrale oksider er karbonmonoksid (CO), lystgass (N₂O) og klordioksid (CLO2).
Ikke -metalliske amfotoriske oksider
Begrepet Anfótero Det refererer til evnen til en kjemisk forbindelse til å oppføre seg som en syre eller som en base, avhengig av hvem som reagerer på. Det vil si at dette er forbindelser som er både syrer og baser samtidig.
- Blant de amfotiske ikke -metalliske oksydene er det vanligste vann (h2ENTEN). Vannet er amfotent, siden det er i stand til å gi et proton til en base (fungerer som en syre), men det er også i stand til å motta et proton av en syre (fungerer som en base).
Eksempler på ikke -metalliske oksider
De vanligste ikke -metalliske oksydene til hver ikke -metall er presentert nedenfor, sammen med dens molekylære formel, navnet i henhold til den systematiske nomenklaturen til IUPAC, i henhold til aksje -nomenklaturen og i henhold til den tradisjonelle nomenklaturen:
Karbonoksider
Formel | IUPAC systematisk navn | Lager nomenklatur | Tradisjonelt navn |
Co | Karbonmonoksid | Karbonoksid (II) | Kullsyreanhydrid |
CO2 | Karbondioksid | Karbonoksid (IV) | Karbonisk anhydrid |
Nitrogenoksider
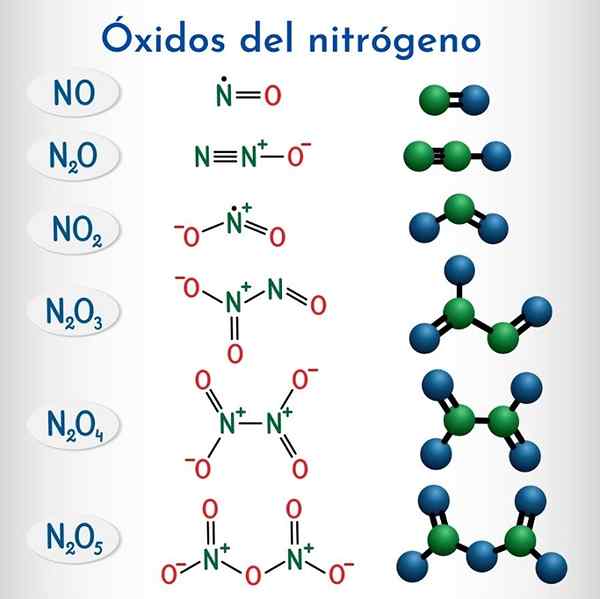 Formler og strukturer av de 6 ikke -metalliske nitrogenoksydene
Formler og strukturer av de 6 ikke -metalliske nitrogenoksydene Formel | IUPAC systematisk navn | Lager nomenklatur | Tradisjonelt navn |
N2o | Dinitrogenmonoksid | Nitrogenoksid (i) | Nitrogenoksid (Hiponitroso anhydrid) |
NEI | Nitrogenmonoksid | Nitrogenoksid (II) | Nitrogenoksid |
N2O3 | Dinitrogentrioxide | Nitrogenoksid (III) | Lystgassanhydrid |
N2O4 | Dinitrogen tetraxide | Nitrogenoksid (IV) | Nitrogentraksid |
NO2 | Nitrogendioksid | Nitrogenoksid (IV) | Nitrogendioksid |
N2O5 | Dinitrogen pentaoksid | Nitrogenoksid (V) | Nitrogenanhydrid |
Fosforoksider
Formel | IUPAC systematisk navn | Lager nomenklatur | Tradisjonelt navn |
P2O3 | Difosfacking trioksid | Fosforoksyd (III) | Fosforanhydrid |
P2O5 | Difosfack pentaoksid | Fosforoksyd (V) | Fosforanhydrid |
P2O4 | Difosfack tetraxide | Fosforoksyd (III, V) | --- |
Arsenoksider
Formel | IUPAC systematisk navn | Lager nomenklatur | Tradisjonelt navn |
AS2O3 | Diarsenisk trioksid | Arsenoksid (III) | Arsenioso -anhydrid |
AS2O5 | Diarsen pentaoksid | Arsenoksid (V) | Arsen anhydrid |
Antimonoksider
Formel | IUPAC systematisk navn | Lager nomenklatur | Tradisjonelt navn |
SB2O3 | DIANTIMONS TRIOXIDE | Antimonoksid (III) | Antimonious anhydrid |
SB2O5 | Diantimon Pentaoxide | Antimonoksid (V) | Antimonisk anhydrid |
Svoveloksider
Formel | IUPAC systematisk navn | Lager nomenklatur | Tradisjonelt navn |
SW | Svovelmonoksid | Svoveloksid (II) | Hyposulfurøs anhydrid |
SO2 | Svoveldioksid | Svoveloksid (IV) | Svovelanhydrid |
SO3 | Svoveltrioksid | Svoveloksid (VI) | Svovisk anhydrid |
Selenoksider
Formel | IUPAC systematisk navn | Lager nomenklatur | Tradisjonelt navn |
Seo | Selenmonoksid | Selenoksid (II) | Hypiplolen anhydrid |
SEO2 | Selen -dioksid | Selenoksid (IV) | Selenary anhydrid |
SEO3 | Selen -trioksid | Selenoksid (VI) | Selénisk anhydrid |
Telurio oksider
Formel | IUPAC systematisk navn | Lager nomenklatur | Tradisjonelt navn |
Teo | Telurio Monoxide | Telurio Oxide (II) | Hypelurøs anhydrid |
Teo2 | Telurio dioksid | Telurio Oxide (IV) | Telt anhydrid |
Teo3 | Telurio trioxide | Telurio Oxide (VI) | Telluric Anhydride |
Kloroksider
Formel | IUPAC systematisk navn | Lager nomenklatur | Tradisjonelt navn |
Cl2o | Klormonoksid | Kloroksid (i) | Hypoklorisk anhydrid |
Cl2O3 | Klortrioksid | Kloroksid (III) | Kloranhydrid |
Cl2O5 | Klorpentaoksid | Kloroksid (V) | Klorisk anhydrid |
Cl2O7 | Klor heptoksyd | Kloroksid (VII) | Perklorisk anhydrid |
Bromoksider
Formel | IUPAC systematisk navn | Lager nomenklatur | Tradisjonelt navn |
BR2O | Brommonoksid | Bromoksid (i) | Hipobromous anhydrid |
BR2O3 | Bromtrioksid | Bromoksid (III) | Bromisk anhydrid |
BR2O5 | Brom pentaoksid | Bromoksid (V) | Bromisk anhydrid |
BR2O7 | Brom heptaoksid | Bromoksid (vii) | Perbromisk anhydrid |
Jodoksider
Formel | IUPAC systematisk navn | Lager nomenklatur | Tradisjonelt navn |
I2o | Jodmonoksid | Jodoksid (i) | Hypoyodoso anhydrid |
I2O3 | Jod trioksid | Jodoksid (III) | Yodoso -anhydrid |
I2O5 | Jod pentaoksid | Jodoksid (V) | Yodiumanhydrid |
I2O7 | Jod heptoksyd | Jodoksid (VII) | Periódicoic Anhydride |

