Kalium Yodato (KIO3)
- 3571
- 506
- Prof. Theodor Gran
Hva er kaliumjodat?
Kalium eller kalium Yodato Yodato er en uorganisk jodforbindelse, spesielt et salt, hvis kjemiske formel er kio3. Jod eller jod, element i halogengruppen (F, Cl, Br, I, AS), har i dette saltet et oksidasjonsnummer på +5; Dette er grunnen til at det er et sterkt oksidasjonsmiddel. Kio3 Det dissosierer i vandig medium for å lage k -ionene+ og io3-.
Det syntetiseres ved å reagere kaliumhydroksyd med yodiumsyre: HIO3(aq) + koh (er) => kio3(aq) + h2Eller (l). Det kan også syntetiseres ved å reagere molekylær jod med kaliumhydroksyd: 3i2(S)+6KOH (S) => Kio3(aq) + 5ki (aq) + 3H2Eller (l).
Kalium Yodato -egenskaper
 Kalium Yodato utseende
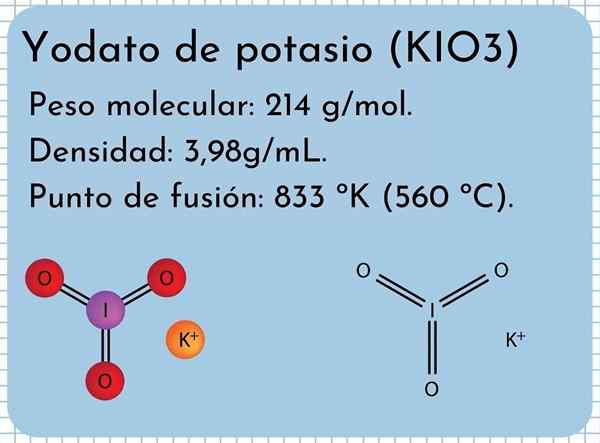
Kalium Yodato utseende Det er et luktfritt hvitt faste, fine krystaller og med en monoklinisk krystallinsk struktur. Den har en tetthet på 3,98 g/ml, en molekylvekt på 214 g/mol og presenterer absorpsjonsbånd i det infrarøde spekteret (IR).
Det har et smeltepunkt: 833 ºK (560 ºC), bestående av sterke ioniske interaksjoner mellom K -ioner+ og io3-. Ved høyere temperaturer, en termisk nedbrytningsreaksjon, frigjør molekylært oksygen og kaliumjodid:
2kio3(S) => 2ki (S) + 3O2(g)
I vann har det løseligheter som varierer fra 4,74 g/100 ml til 0 ºC, opp til 32,3 g/100 ml ved 100 ºC, og genererer fargeløse vandige oppløsninger. I tillegg er det uoppløselig i alkohol og salpetersyre, men den er løselig i fortynnet svovelsyre.
Affiniteten til vann er ikke nevneverdig, noe som forklarer hvorfor det ikke er hygroskopisk og ikke eksisterer i form av hydratiserte salter (kio3· H2ENTEN).
Oksidasjonsmiddel
Kalium Yodato, som indikert av dens kjemiske formel, har tre oksygenatomer. Dette er et sterkt elektronegativt element, og på grunn av denne egenskapen etterlater det "oppdaget" en elektronisk skymangel som omgir jod.
Kan tjene deg: inerte gasserDenne mangelen - eller bidraget, som tilfellet kan være - kan beregnes som oksidasjonsnummeret til jod (± 1, +2, +3, +5, +7), å være +5 i tilfelle av dette saltet.
Hva betyr dette? Det før en art som er i stand til å gi sine elektroner, vil jod akseptere dem i sin ioniske form (IO3-) å bli molekylært jod og ha et oksidasjonsnummer lik 0.
Etter denne forklaringen kan det bestemmes at kaliumjodat er en oksiderende forbindelse som reagerer intenst med reduksjonsmidler i mange redoksreaksjoner; Av alle disse er man kjent som en jodklokke.
Jodklokken består av en redoksprosess med langsomme og raske trinn, der de raske trinnene er preget av en KIO -løsning3 I svovelsyre som stivelse tilsettes. Deretter produserte og forankret stivelsen mellom dens struktur arten i3-- Det vil gjøre den fargerike blå løsningen til mørkeblå.
Io3- + 3 HSO3- → i- + 3 HSO4-
Io3- + 5 i- + 6 timer+ → 3 i2 + 3 H2ENTEN
Yo2 + HSO3- + H2O → 2 i- + HSO4- + 2 h+ (mørkeblått på grunn av stivelsen)
Kjemisk struktur
 Kalium Yodato -struktur
Kalium Yodato -struktur I det overordnede bildet illustreres den kjemiske strukturen til kaliumjodat. IO -anionen3- Det er representert av "stativet" av røde og lilla kuler, mens K -ionene+ De er representert av lilla sfærer.
Men hva betyr disse stativene? De riktige geometriske formene til disse anionene er faktisk trigonale pyramider, der oksygenet utgjør den trekantede basen, og det ikke-delte dreiemomentet til jodpeker oppe, okkuperer plass og tvang til å brette ned I-O-lenken og de to lenkene i = o.
Kan tjene deg: TartarsyreDenne molekylære geometrien tilsvarer en SP -hybridisering3 av det sentrale atomet av jod; Et annet perspektiv antyder imidlertid at et av oksygenatomene danner koblinger til orbitalene "d" av jod, og faktisk er en hybridisering av SP -typen3d2 (Jod kan ha sine "D" -baner som utvider Valencia -laget).
Krystallene i dette saltet kan lide strukturelle faseoverganger (andre arrangementer enn monoklinisk) som en konsekvens av de forskjellige fysiske forholdene som utsetter dem.
Bruk og applikasjoner av kaliumjodat
Terapeutisk bruk
Kalium Yodato brukes vanligvis for å unngå akkumulering av radioaktivitet i skjoldbruskkjertelen i form av 131Jeg, når denne isotopen brukes til å bestemme jod av skjoldbruskkjertelen som en del av driften av skjoldbruskkjertelen.
På samme måte brukes kalium Yodato som et aktuelt antiseptisk middel (0,5 %) i slimhinner.
Bruk i industrien
Det legges til maten til å avle dyr som et jodtilskudd. Derfor brukes kalium Yodato i bransjen for å forbedre kvaliteten på melet.
Analytisk bruk
I analytisk kjemi, takket være stabiliteten, brukes den som et primært mønster i standardiseringen av natriumtiosulfatmønstre (NA2S2ENTEN3), med det formål å bestemme jodkonsentrasjoner i problemene problemer.
Dette betyr at jodmengder kan være kjent med volumetriske teknikker (grader). I denne reaksjonen oksiderer kaliumjodatet raskt til jodidionene I-, Gjennom følgende kjemiske ligning:
Kan tjene deg: blyacetat: struktur, egenskaper, innhenting, brukIo3- + 5i- + 6H+ => 3i2 + 3H2ENTEN
Jod, jeg2, har tittelen med NA -løsningen2S2ENTEN3 for sin standardisering.
Brukes i laserteknologi
Studier har vist og bekreftet de interessante piezoelektriske, pyroelektriske, elektrooptiske, ferroelektriske og ikke -lineære optikkegenskapene til KIO -krystaller3. Dette resulterer i store potensialer i det elektroniske feltet og i teknologien til laserne for materialer laget med denne forbindelsen.
Helserisiko ved kalium Yodate
I høye doser kan det gi irritasjoner i orale slimhinner, hud, øyne og luftveier.
Eksperimentene med toksisiteten til kaliumjodatet hos dyr har tillatt oss å observere at hos hunder i en rask, i doser på 0,2-0,25 g/kg kroppsvekt, tilført oralt, forårsaker forbindelsen oppkast.
Hvis disse oppkast unngås, produserer den hos dyr en forverring av situasjonen, siden en anoreksi og før døden blir indusert. Hans obduksjoner tillot å observere nekrotiske leverlesjoner, nyrer og tarmslimhinne.
På grunn av sin oksidasjonskraft representerer den en risiko for brann når den kommer i kontakt med brennbare materialer.
Referanser
- Dag, r., & Underwood, a. Kvantitativ analytisk kjemi (Femte utg.). Pearson Prentice Hall, P-364.
- ChemicalBook. (2017). Kaliumjodat. Hentet 25. mars 2018, fra ChemicalBook: ChemicalBook.com
- Pubchem. (2018). Kaliumjodat. Hentet 25. mars 2018 fra Pubchem: Pubchem.NCBI.NLM.NIH.Gov
- Merck. (2018). Kalium Yodato. Hentet 25. mars 2018, fra Merck:
- Merckmillipore.com
- M M Abdel Kader et al. (2013). Ladetransportmekanisme og lavtemperaturfaseoverganger i KIO3. J. Phys.: Konf. Være. 423 012036

