Yoduro men egenskaper, struktur, funksjoner
- 2302
- 718
- Marius Aasen
De Yoduro Peroxidase eller skjoldbruskkjertelperoksidase (TPO) er et hemo-glykoprotein som tilhører familien til pattedyrperoksidaser (for eksempel myeloperoxidase, laktoperoksidase og andre) som deltar i syntesen av skjoldbruskkjertelhormonet.
Hovedfunksjonen er "jodinasjon" av tyrosinavfall i tyoglobulin, og dannelsen av 3-3'-5-triiodothyronin (T3) og tyroksin (T4) gjennom en "kobling" -reaksjon intramolekylær av iodiserte tyrosiner.
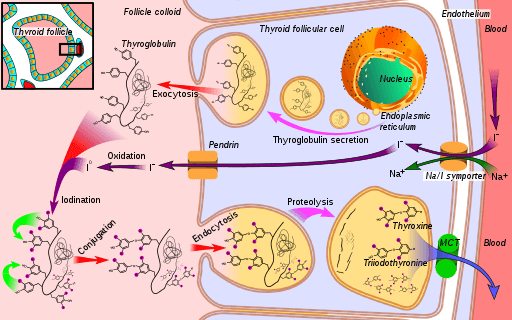
 Skjema for den biosyntetiske ruten til skjoldbruskhormonet, hvor jodidperoksidase (i oksidasjonen av jodid til jod) (kilde: Mikael Häggström [CC0] via Wikimedia Commons)
Skjema for den biosyntetiske ruten til skjoldbruskhormonet, hvor jodidperoksidase (i oksidasjonen av jodid til jod) (kilde: Mikael Häggström [CC0] via Wikimedia Commons) Triiodynonin og tyroksin er to hormoner produsert av skjoldbruskkjertelen som har essensielle funksjoner i utvikling, differensiering og metabolisme av pattedyr. Handlingsmekanismen avhenger av interaksjonen mellom dens kjernefysiske reseptorer med spesifikke gensekvenser av dets hvite gener.
Eksistensen av Yoduro Peroxidase -enzymet ble bekreftet på 1960 -tallet av forskjellige forfattere, og for øyeblikket er det gjort betydelige fremskritt når det gjelder bestemmelse av dets struktur, dets funksjoner og egenskapene til genet som koder det i forskjellige organismer.
I store deler av litteraturen relatert til dette enzymet er dette kjent som det mikrosomale "autoantigen" og er relatert til noen skjoldbruskkjertel autoimmune sykdommer.
Takket være de immunogene egenskapene, er dette enzymet et hvitt eller målmolekyl.
[TOC]
Kjennetegn
Peroksidase -jodid er kodet av et gen lokalisert på kromosom 2 av mennesker, som måler mer enn 150 kpb og er sammensatt av 17 eksoner og 16 introner.
Dette transmembraale proteinet, med et enkelt segment nedsenket i membranen, er nært beslektet med myeloperoxidase, som det deler mer enn 40% av likheten i aminosyresekvens.
Kan tjene deg: acylglycerider: egenskaper, struktur, typer, funksjonerSyntesen forekommer i polyribosomer (sett med ribosomer som er ansvarlige for oversettelsen av det samme proteinet) og blir deretter satt inn i endoplasmatisk retikulummembran, hvor den går gjennom en glykosyleringsprosess.
Når den er syntetisert og glykosylert, transporteres peroksidasejodid til den apikale polen til trekket (skjoldbruskceller eller skjoldbruskceller), der den er i stand til å eksponere det katalytiske sentrum mot follikulær lumen i skjoldbruskkjertelen.
Ekspresjonsregulering
Ekspresjonen av kodingsgenet til skjoldbruskkjertelen eller jodidperoksidase styres av spesifikke skjoldbrusktranskripsjonsfaktorer som TTF-1, TTF-2 og PAX-8.
De genetiske elementene som gjør det mulig å øke eller forbedre uttrykket av dette genet hos mennesker, er blitt beskrevet i regionene som flankerer enden 5 'av det samme, vanligvis blant de første 140 baseparene i denne regionen "flanqueant".
Det er også elementer som undertrykker eller reduserer uttrykket av dette proteinet, men i motsetning til "potensiatorene", er disse blitt beskrevet nedstrøms for gensekvensen.
Mye av reguleringen av det genetiske uttrykket av jodidperoksidase forekommer på en vevsspesifikk måte, og dette avhenger av virkningen av DNA-unionselementer som virker i Cis, for eksempel transkripsjonsfaktorer TTF-1 og andre.
Struktur
Dette proteinet med enzymatisk aktivitet har omtrent 933 aminosyreavfall og en ekstracellulær C-terminale ende av 197 aminosyrer som kommer fra ekspresjonen av andre genmoduler som koder for andre glykoproteiner.
Molekylvekten er rundt 110 kDa og er en del av den glykosylerte transmembranale proteingruppen av type 1, siden den har et glykosylert transmembranalt segment og en hemo -gruppe i sitt aktive aktive sted.
Det kan tjene deg: kjertler: typer, funksjon, betennelse og sykdommerStrukturen til dette proteinet har i det minste en disulfidbro i det ekstracellulære området som danner en karakteristisk lukket sløyfe som er utsatt på overflaten av tirocyttene.
Funksjoner
Den viktigste fysiologiske funksjonen til peroksidase -jodidet er relatert til den Rester i thyoglobulin.
Hva er syntesen av skjoldbruskkjertelhormon?
For å forstå funksjonen til skjoldbruskkjertelen peroksidase -enzymet er det nødvendig å vurdere trinnene i den hormonelle syntesen der den deltar:
1 sak med transport av jodid til skjoldbruskkjertelen og fortsetter med
2-generering av et oksidasjonsmiddel som hydrogenperoksyd (H2O2)
3-posteriort et mottakende protein syntetiseres, thyoglobulin
4-yoduro er oksidert til en tilstand av eldre Valencia og etter
5-Yoduro er sammen med tyrosinavfall til stede i thyoglobulin
6-i thyoglobulin, jodotye (en type skjoldbruskhormoner) dannes på grunn av ryodotisk avfallskobling
7-Tyoglobulin lagres og sparteres, da
8-Iodirosinas Iodirosinas fjernes og til slutt,
9-tyroksin frigjøres og triiodothyron mot blod; Disse hormonene utøver sine effekter ved interaksjon med deres spesifikke reseptorer, som er lokalisert i kjernemembranen og er i stand til å samhandle med hvite DNA -sekvenser, og fungerer som transkripsjonsfaktorer.
Som det kan løsrives fra kunnskapen om funksjonene til de to hormonene hvis syntese deltar (T3 og T4), har peroksidase -jodid viktige implikasjoner på fysiologisk nivå.
Mangelen på begge hormoner under menneskelig utvikling gir mangler i vekst og psykisk utviklingshemning, så vel som metabolske ubalanser i voksenlivet.
Kan tjene deg: Holoenzym: Kjennetegn, funksjoner og eksemplerRelaterte sykdommer
Peroxidase -jodid er en av de viktigste skjoldbruskkjertelen autoantigener hos mennesker og er relatert til cytotoksisitet mediert av komplementsystemet. Funksjonen som autoantigen skiller seg ut hos pasienter med skjoldbruskkjertel autoimmune sykdommer.
GOTA -sykdom skyldes for eksempel en mangel på jodinnhold under hormonell syntese i skjoldbruskkjertelen, som har vært knyttet til et tyroglobulinjodinasjonsmangelprodukt av visse defekter i visse defekter i peroksidase peroksidase.
Noen karsinomer er preget av å ha endrede funksjoner av peroksidasejodid, det vil si at aktivitetsnivåene til dette enzymet er betydelig lavere enn hos ikke -kreftpasienter.
Studier har imidlertid bekreftet at det er en ekstremt variabel egenskap, som ikke bare avhenger av pasienten, men av krefttypen og de berørte regionene.
Referanser
- DeGroot, l. J., & Niepomniszcze, h. (1977). Biosyntese av skjoldbruskkjertelhormon: grunnleggende og kliniske aspekter. Fremgang i endokrinologi og metabolisme, 26(6), 665-718.
- Fragu, s., & Nataf, b. M. (1976). Menneskelig skjoldbruskkjertelperoksidaseaktivitet ved godartede og ondartede skjoldbruskkjertelforstyrrelser. Det endokrine samfunnet, Fire fem(5), 1089-1096.
- Kimura, s., & Ikeda-Saito, m. (1988). Human myeloperoxidae og skjoldbruskkjertelperoksidase, to enzymer med separate og distinkte fysiologiske funksjoner, er evolusjonsrelaterte medlemmer av samme gengenfamilie. Proteiner: struktur, funksjon og bioinformatikk, 3, 113-120.
- Nagasaka, a., Hidaka, h., & Ishizuki, og. (1975). Studier av humant jodid peroksidase: dens aktivitet ved forskjellige skjoldbruskkjertelforstyrrelser. Clinic Chemical Act, 62, 1-4.
- Ruf, J., & Carayon, P. (2006). Strukturelle og funksjonelle aspekter ved skjoldbruskkjertelperoksidase. Arkiv for biokjemi og biofysikk, 445, 269-277.
- Ruf, J., Toubert, m., Czarnocka, f., Durand-Gorde, m., Ferrand, m., & Carayon, P. (2015). Forholdet mellom immunologisk struktur og biokjemiske egenskaper til humant skjoldbruskkjertelperoksidase. Endokrine anmeldelser, 125(3), 1211-1218.
- Taurog, a. (1999). Molekylær evolusjon av skjoldbruskkjertelperoksidase. Biochimie, 81, 557-562.
- Zhang, J., & Lazar, m. TIL. (2000). Virkningsmekanismen til skjoldbruskhormoner. Annu. Rev. Fysiol., 62(1), 439-466.

