50 eksempler på syrer og baser

- 2708
- 509
- Oliver Christiansen
Det er hundrevis Eksempler på syrer og baser som finnes i alle kjemiens grener, men at de som helhet blir skilt i to store familier: uorganiske og organiske. Uorganiske syrer er vanligvis kjent som mineralsyrer, preget av å være spesielt sterke sammenlignet med organisk.
Syrer og baser forstås som stoffer som har forskjellige smaker eller saponáceos, henholdsvis. Begge er etsende, selv om ordet 'kaustisk' vanligvis brukes til sterke baser. Oppsummert kontoer: De brenner og driver huden hvis de berører den. Karakteristikkene i løsemiddelmedier har planlagt en serie definisjoner gjennom historien.
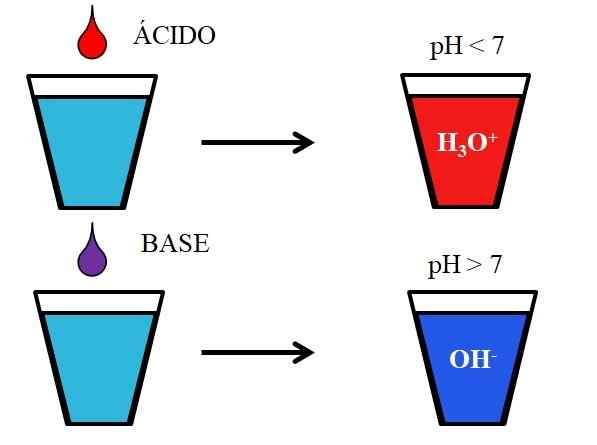 Oppførsel av syrer og baser når de blir oppløst i vann. Kilde: Gabriel Bolívar.
Oppførsel av syrer og baser når de blir oppløst i vann. Kilde: Gabriel Bolívar. Det nedre bildet viser den generiske oppførselen til syrer og baser når de blir tilsatt eller oppløst i et glass med vann. Syrer produserer løsninger med pH -verdier under 7 på grunn av hydroniosioner, h3ENTEN+; Mens basene produserer løsninger med pH over 7 på grunn av hydroksylioner (eller oksydril), OH-.
Hvis vi tilsetter saltsyre, HCl (rød dråpe), til glasset, vil det være H -ioner3ENTEN+ og cl- hydrert. På den annen side, hvis vi gjentar eksperimentet med natriumhydroksid, NaOH (lilla dråpe), vil vi ha OH -ioner- og na+.
[TOC]
Definisjoner

Karakteristikkene, i økende grad studert og forstått, av syrer og baser setter mer enn en definisjon for disse kjemiske forbindelsene. Blant disse definisjonene har vi den fra Arrhenius, den fra Bronsted-Lowry, og til slutt Lewis. Før du siterer eksemplene er det nødvendig å ha dette klart.
Arrhenius
Syrer og baser, ifølge Arrhenius, er de som oppløst i vannproduserer H -ioner3ENTEN+ eller åh-, henholdsvis. Det vil si at bildet allerede representerer denne definisjonen. Imidlertid forakter det i seg selv noen for svake syrer eller baser til å produsere slike ioner. Det er her definisjonen av Bronsted-Lowry kommer inn.
Kan tjene deg: syrer: egenskaper og eksemplerBronsted-Lowry
Bronsted-lavsyrer er de som kan donere ioner h+, Og basene er de som godtar disse h+. Hvis en syre donerer veldig enkelt+, Det betyr at det er en sterk syre. Det samme gjelder basene, men aksepterer h+.
Dermed har vi sterke eller svake syrer og baser, og kreftene deres måles i forskjellige løsningsmidler; Spesielt i vannet, hvorav de kjente pH -enhetene er etablert (fra 0 til 14).
Derfor vil en sterk syre donere H -H fullstendig+ til vannet i en reaksjon av typen:
Ha + h2O => a- + H3ENTEN+
Hvor du skal- Det er den konjugerte basen til ha. Herfra kommer H derfor h3ENTEN+ til stede i glasset med syreoppløsning.
I mellomtiden vil en svak B -base ubeskyttet vannet for å få sin respektive h+:
B + H2Eller HB + OH-
Der Hb er den konjugerte syren til B. Dette er tilfelle av ammoniakk, NH3:
NH3 + H2Eller NH4+ + Åh-
En veldig sterk base kan direkte donere OH -ioner- Ingen grunn til å reagere med vann; Som med Naoh.
Lewis
Endelig er Lewis -syrer de som vinner eller aksepterer elektroner, og Lewis baser er de som donerer eller mister elektroner.
For eksempel Bronsted-Lowry NH-basen3 Det er også en Lewis -base, siden nitrogenatomet godtar en H+ Ved å donere dette paret med gratis elektroner (h3N: h+). Det er grunnen til at de tre definisjonene ikke er uenige med hverandre, men de fletter sammen og hjelper til med å studere surhet og grunnleggende i et bredere spekter av kjemiske forbindelser.
Kan tjene deg: nikkel: historie, egenskaper, struktur, bruk, risikoEksempler på syrer
Etter å ha avklart definisjonene, vil en serie syrer bli nevnt nedenfor med sine respektive formler og navn:
-HF: Fluorhydronsyre
-HBR: Bromhydronsyre
-Hei: Yodhydronsyre
-H2S: Sulfhydrisk syre
-H2SE: seleenhydronsyre
-H2TE: Telurhydrisk syre
Dette er binære syrer, også kalt hydraceids, som tilhører den nevnte saltsyre, HCl.
-Hno3: salpetersyre
-Hno2: Lystgass
-HNO: Hyponitrous acid
-H2Co3: Kullsyre
-H2Co2: karbonososyre, som faktisk er kjent mer med navnet maursyre, hcooh, den enkleste organiske syre av alle
-H3Po4: fosforsyre
-H3Po3 eller h2[HPO3]: Fosforsyre, med en H-P-binding
-H3Po2 eller h [h2Po2]: Hypofosfærisk syre, med to H-P-bindinger
-H2SW4: svovelsyre
-H2SW3: Svovelsyre
-H2S2ENTEN7: disulfurinsyre
-HIO4: periódinsyre
-HIO3: Yodium syre
-HIO2: Jodosesyre
-Hio: Hypoyodososyre
-H2Cro4: kromsyre
-Hmno4: Manganyre
-Ch3COOH: eddiksyre (eddik)
-Ch3SW3H: Metanosulfonsyre
Alle disse syrene, bortsett fra de formiske og de to siste, er kjent som oksácidos eller ternære syrer.
Andre:
-Alcl3: aluminiumklorid
-FECL3: jernklorid
-Bf3: Boro Trifluoruro
-Metallkationer oppløst i vann
-Karbokasjoner
-H (CHBelleveClelleve): Super Acid Carborano
- Fso3H: Fluorosulfonsyre
- HSBF6: Fluorantimonsyre
- Fso3H · SBF5: Magisk syre
De fire siste eksemplene utgjør de fryktelige supersyrene; Forbindelser som er i stand til å gå i oppløsning nesten alle materialer med knapt berører det. ALCL3 Det er et eksempel på Lewis -syre, siden aluminiummetallsenteret er i stand til å akseptere elektroner på grunn av dens elektroniske mangel (det fullfører ikke Valencia -oktetten).
Kan tjene deg: kvikksølvhydroksid: struktur, egenskaper, bruksområder, risikoerEksempler på baser
Blant de uorganiske basene har vi metallhydroksider, for eksempel natriumhydroksyd, og noen molekylære hydurner, for eksempel ammoniakk som allerede er sitert. Her er andre eksempler på baser:
-KOH: Kaliumhydroksid
-Lioh: Litiumhydroksyd
-RBOH: Rubidio hydroxide
-CSOH: Cesiumhydroksid
-Froh: Francio hydroxide
-Være (å)2: Berylhydroksyd
-MG (OH)2: magnesiumhydroksyd
-CA (OH)2: kalsiumhydroksid
-Sr (OH)2: Strontiumhydroksyd
-Ba (oh)2: Bariumhydroksyd
-Ra (å)2: radiohydroksyd
-Tro (å)2: jernhydroksyd
-Tro (å)3: jernhydroksyd
-Al (å)3: aluminiumhydroksyd
-PB (OH)4: Plúmbisk hydroksyd
-Zn (OH)2: sinkhydroksyd
-CD (OH)2: kadmiumhydroksyd
-Cu (OH)2: Cupric hydroxide
-Ti (å)4: Titanic hydroxide
-Ph3: fosfin
-Aske3: Arsina
-Nanh2: natrium amiduro
- C5H5N: Pyridin
-(Ch3) N: trimetylamin
- C6H5NH2: Fenylamin eller anilin
-Nah: natriumhydrid
-KH: Kaliumhydrid
-Karbanioner
-Li3N: litiumnitrid
-Alcoxides
-[(Kap3)2CH]2NLI: Diisopropilamid av litium
-Dietinilbenzen Anion: C6H4C42- (den sterkeste basen som er kjent så langt)
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Naomi Hennah. (10. oktober 2018). Hvordan lære syrer, baser og salter. Gjenopprettet fra: Edu.RSC.org
- Helmestine, Anne Marie, PH.D. (31. august 2019). Formler av vanlige syrer og baser. Gjenopprettet fra: Thoughtco.com
- David Wood. (2019). Sammenlign vanlige syrer og baser. Studere. Gjenopprettet fra: Studie.com
- Ross Pomeroy. (23. august 2013). Verdens sterkeste syrer: som ild og is. Gjenopprettet fra: realclearscience.com
- Wikipedia. (2019). Diethynylbenzene dianion. Hentet fra: i.Wikipedia.org
- « Diameter symboler og formler, hvordan du tar det ut, omkrets
- Økofysiologi Hvilke studier og anvendelser i dyr og grønnsaker »

