Acrilonitrilstruktur, egenskaper, produksjon, bruk

- 3394
- 993
- Jonathan Moe
Han Acrilonitril Det er en organisk forbindelse med kondensert formel2Chcn. Det er en av de enkleste nitrilene som finnes. Kjemi og strukturelt er det ikke noe mer enn produktet fra foreningen mellom en vinylgruppe, Cho2= Ch-, og en nitril, cyanidgruppe, C≡N. Det er et stoff med stor industriell innvirkning på plastverdenen.
Fysisk er det en fargeløs væske, med en viss lukt av løk, og at i uren tilstand presenterer gulaktige toner. Det er svært brennbar, giftig og muligens kreftfremkallende, så det er klassifisert som et ekstremt farlig stoff. Ironisk nok er de med det produsert plast og leker i dagliglivet, for eksempel Tupperware og Lego -blokker.
 Acrilonitrilpolymerer er til stede i Tupperware -plast. Kilde: Stebulus via Wikipedia.
Acrilonitrilpolymerer er til stede i Tupperware -plast. Kilde: Stebulus via Wikipedia. På industrielle skalaer, Acrilonitril. Nesten alt det produserte mengden er beregnet på fremstilling av plast, basert på homopolymerer, for eksempel polyakrylonitril, eller i kopolymerer, for eksempel akrilonitril-butadienestyren.
[TOC]
Acrilonitrilstruktur
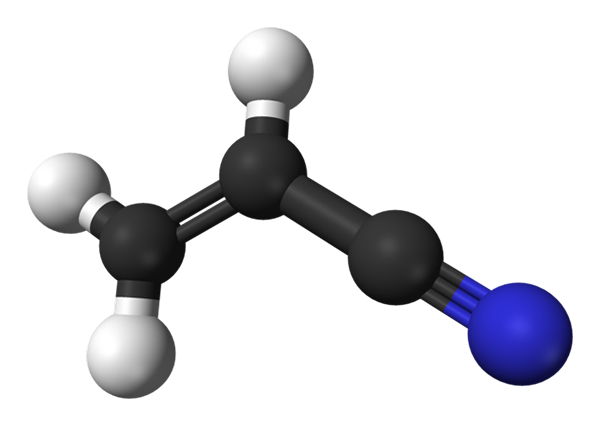 Molekylær struktur av akrilonitril. Kilde: Benjah-BMM27 / Public Domain
Molekylær struktur av akrilonitril. Kilde: Benjah-BMM27 / Public Domain I det øvre bildet har vi det akilonitrilmolekylet representert med en modell av kuler og søyler. De svarte kulene tilsvarer karbonatomer, mens henholdsvis hvite og blå til hydrogen- og nitrogenatomer. Venstre, CH2= CH- tilsvarer vinylgruppen, og høyre, til cyanogruppen, C≡N.
Hele molekylet er flatt, fordi karbonene i vinylgruppen har SP -hybridisering2. I mellomtiden har Ciano Group -karbon SP -hybridisering, og er ved siden av nitrogenatomet i en linje som hviler på samme plan som resten av molekylet.
CN -gruppen bidrar med polaritet til molekylet, så molekylet Cho2CHCN etablerer en permanent dipol der den høyeste elektroniske tettheten er rettet mot nitrogenatom. Derfor dipol-dipol.
Kan tjene deg: Hva er kjemisk periodisitet?Molekylene kap2CHCN er flate, og kan forvente at de i krystaller (størknet ved -84 ºC) er tilgjengelige på hverandre, for eksempel laken eller laken, slik at dipolene deres ikke frastøter.
Egenskaper
Fysisk utseende
Fargeløs væske, men med gulaktige toner når den presenterer noen urenheter. Når det, anbefaler de å destillere det før den ble brukt. Den er flyktig og har også en intens lukt som ligner på løken.
Molmasse
53.064 g/mol
Smeltepunkt
-84 ºC
Kokepunkt
77 ºC
Flash Point
-5 ºC (lukket kopp)
0 ºC (åpen kopp)
Selvordemperatur
481 ºC
Tetthet
0,81 g/cm3
Damptetthet
1.83 i luftforhold.
Damptrykk
109 mmHg ved 25 ºC
Løselighet
I vannet har det en løselighet på 74 g/l til 25 ºC. Acrilonitril er også betydelig løselig i aceton, olje, etanol, etylacetat og benzenetanile.
Nedbrytning
Når termisk frigjør giftig hydrogencyanid, karbonoksider og nitrogenoksider.
Produksjon
Sohio -prosessen
Akryonitril kan oppstå med massive skalaer gjennom mange reaksjoner og kjemiske prosesser. Av dem alle er Sohio -prosessen den mest brukte, som består av den katalytiske amaxidering av propylenet. I en fluidisert sengreaktor blandes propylenet med luft og ammoniakk ved en temperatur rundt 400 og 510 ºC, hvor de reagerer på faste katalysatorer.
Reaktantene kommer inn i reaktoren en gang, og finner sted følgende reaksjon:
2ch3−Ch = Ch2 + 2 nh3 + 3 o2 → 2 Ch2= Ch-c-c≡N + 6 H2ENTEN
Merk at oksygen reduseres til vann, mens propylen oksiderer akrilonitril. Derav navnet 'amoxidation', fordi det er en oksidasjon som innebærer deltakelse av ammoniakk.
Kan tjene deg: Kokende: konsept, typer og eksemplerAlternative prosesser
I tillegg til Sohio -prosessen, kan andre reaksjoner nevnes som tillater innhenting av akrilonitril. Det er klart at ikke alle er skalerbare, eller i det minste på en tilstrekkelig lønnsom måte, og genererer heller ikke produkter med høy ytelse eller renhet.
Akrylonitril syntetiseres, igjen fra propylen, men får den til å reagere med nitrogenoksid på PBO -katalysatorer2-Zro2 Airgel -formet. Reaksjonen er som følger:
4 Ch3−Ch = Ch2 + 6 Nei → 4 Cho2= Ch-c-c≡N + 6 H2Eller + n2
En reaksjon som ikke involverer propylen er den som begynner med etylenoksyd, som reagerer med hydrogensyanid for å transformere til etylen -cyanohydrin; Og senere blir det dehydrert ved en temperatur på 200 ºC i akrilonitril:
ETO + HCN → CH2Ohch2CN
Ch2Ohch2CN + Q (200 ºC) → CH2= CH-C-N +H2ENTEN
En annen mye mer direkte reaksjon er tilsetning av hydrogensyanid på acetylen:
HC≡CH + HCN → CH2= CH-C-n
Imidlertid dannes mange sekundære produkter, så kvaliteten på akrilonitril er lavere sammenlignet med den for Sohio -prosessen.
I tillegg til de nevnte stoffene, laktonitril, propionitril.
applikasjoner
 Legos er hovedsakelig produsert med ABS -plast, en kopolymer der akilonitril er en del. Kilde: Pxhere.
Legos er hovedsakelig produsert med ABS -plast, en kopolymer der akilonitril er en del. Kilde: Pxhere. Acrilonitril er et uunnværlig stoff for plastindustrien. Flere av hans avledede plast er høyt kjent. Slik er tilfellet med Acrilonitrilo-Butadiene-styren-kopolymerer (ABS), som bitene av lekfolkene er produsert. Vi har også akrylfibre, utdypet med polyakrylonitrilhomopolymer (PAN).
Kan tjene deg: ForlengelseBlant andre plast som inneholder akrilonitril som en monomer, eller som er avhengige av den for dens produksjon, har vi: akrylenstrekk (SAN), butadienakrylonitril (NBR), akrilonitril strekkakrylat (ASA), polstoff.
Rent praktisk kan enhver naturlig polymer, for eksempel bomull, modifiseres ved å inkorporere molekylære strukturer i akrilonitril. Dermed oppnås nitrilderivater, noe som gjør kjemien til den veldig brede akrylonitril.
En av bruken utenfor plastverdenen er som plantevernmidler blandet med karbontetraklorid. På grunn av sin forferdelige innvirkning på det marine økosystemet, har slike plantevernmidler imidlertid forbudt seg selv eller er underlagt sterke begrensninger.
Risiko
Acrilonitril er et farlig stoff, så det må manipuleres med ekstrem omsorg. Enhver upassende eller altfor langvarig eksponering for denne forbindelsen kan være dødelig, enten ved innånding, inntak eller fysisk kontakt.
Den bør opprettholdes så langt som mulig fra en hvilken som helst varmekilde, siden den er en flyktig og veldig brennbar væske. Han skal heller ikke være i kontakt med vann, fordi han reagerer voldsomt med henne.
I tillegg til dette er det et muligens kreftfremkallende stoff, som har vært assosiert med lever- og lungekreft. De som har blitt utsatt for dette stoffet har økning i nivåene av tiocyanat som skilles ut i urinen, og blodcyanid.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10. utgave.). Wiley Plus.
- Wikipedia. (2020). Akrylonitril. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2020). Akrylonitril. PubChem -database., CID = 7855. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Elsevier f.V. (2020). Akrylonitril. Scientedirect. Hentet fra: Scientedirect.com
- Korry Barnes. (2020). Hva er akrylonitril? - Bruk og egenskaper. Studere. Gjenopprettet fra: Studie.com
- Pajonk, g.M., Manzalji, t. (1993). Syntese av akrylonitril fra propylen og nitrogenoksidblandinger på PBO2-Zro2 Airgel -katalysatorer. Catal Lett tjueen, 361-369. gjør jeg.org/10.1007/BF00769488
- « Dynamiske programmeringsegenskaper, eksempel, fordeler, ulemper
- Hva er en isotermisk prosess? (Eksempler, øvelser) »

