Hva er en isotermisk prosess? (Eksempler, øvelser)

- 5101
- 1301
- Oliver Christiansen
Han isotermisk prosess eller isoterm er en reversibel termodynamisk prosess der temperaturen forblir konstant. I en gass er det situasjoner der en endring i systemet ikke gir variasjoner i temperaturen, men i fysiske egenskaper.
Disse endringene er faseendringer, når stoffet endres fra fast til væske, av gassvæske eller omvendt. I slike tilfeller justerer stoffmolekyler sin posisjon, tilsetter eller trekker ut termisk energi.
 Figur 1. Karambanene som smelter er et eksempel på isotermisk prosess. Kilde: Pixabay.
Figur 1. Karambanene som smelter er et eksempel på isotermisk prosess. Kilde: Pixabay. Den termiske energien som er nødvendig for at en faseendring skal oppstå i et stoff kalles latent varme eller transformasjonsvarme.
En måte å få en isotermisk prosess er å kontakte stoffet som vil være systemet som studeres med et eksternt termisk avsetning, som er et annet stort kalorikapasitetssystem. På denne måten skjer en så langsom varmeutveksling, at temperaturen forblir konstant.
Disse typer prosesser er ofte gitt i naturen. For eksempel hos mennesker når kroppstemperaturen øker eller går ned, føler vi oss syke, fordi i kroppen vår er det mange kjemiske reaksjoner som opprettholder livet ved konstant temperatur. Dette er gyldig for varmt blod generelt.
Andre eksempler er isen som smelter med varme når fjær- og isbiter ankommer.
[TOC]
Eksempler på isotermiske prosesser
-Hot -blodige dyr Metabolisme utføres ved konstant temperatur.
 Figur 2. Varme -blodige dyr har mekanismer for å holde temperaturen konstant. Kilde: Wikimedia Commons.
Figur 2. Varme -blodige dyr har mekanismer for å holde temperaturen konstant. Kilde: Wikimedia Commons. -Når vannet koker oppstår en faseendring, av gassvæske, og temperaturen forblir konstant ved omtrent 100 ºC, siden andre faktorer kan påvirke verdien.
-Isen som smelter er en annen hyppig isotermisk prosess, i tillegg til å plassere vann i fryseren for å lage isbiter.
Kan tjene deg: Geometrisk optikk: Hvilke studier, lover, applikasjoner, øvelser-Bilmotorer, kjøleskap, så vel som mange andre typer maskiner, fungerer riktig i et visst temperaturområde. For å opprettholde passende temperatur, kalt enheter Termostater. I sin design brukes forskjellige driftsprinsipper.
Carnots syklus
En Carnot -motor er en ideell maskin som det oppnås arbeid takket være helt reversible prosesser. Det er en ideell maskin fordi den ikke vurderer prosesser som sprer energi, som en viskositet av stoffet som gjør jobben, og heller ikke friksjon.
Carnot -syklusen består av fire trinn, hvorav to er nøyaktig isotermisk og de to andre adiabatiske. De isotermiske stadiene er komprimering og utvidelse av en gass som er ansvarlig for å produsere det nyttige arbeidet.
En bilmotor opererer med lignende prinsipper. Bevegelsen av et stempel inne i sylinderen overføres til andre deler av bilen og produserer bevegelse. Det har ikke oppførselen til et ideelt system som Carnot -motoren, men de termodynamiske prinsippene er vanlige.
Beregning av arbeidet utført i en isotermisk prosess
For å beregne arbeidet utført av et system når temperaturen er konstant, må den første loven om termodynamikk brukes, som sier:
ΔU = q - w
Dette er en annen måte å uttrykke bevaring av energi i systemet, presentert gjennom ΔU eller endring i energi, Q som varmen som leveres og til slutt W, som er arbeidet som er utført av nevnte system.
Anta at det aktuelle systemet er en ideell gass som er inneholdt i sylinderen til et stempel på mobilområdet TIL, Hva fungerer når volumet V endring av V1 til V2.
 Figur 3. I en isotermisk prosess utvides gassen i stempelet uten å endre temperaturen. Kilde: YouTube.
Figur 3. I en isotermisk prosess utvides gassen i stempelet uten å endre temperaturen. Kilde: YouTube. Den ideelle gassstatuslikningen er PV = NRT, som relaterer volumet til presset P og temperaturen T. Verdiene til n og r er konstante: n er antall mol av gassen og r gassen konstant. I tilfelle av en isotermisk prosess produktet PV det er konstant.
Kan tjene deg: Antoinkonstanter: Formler, ligninger, eksemplerVel, arbeidet som er utført beregnes ved å integrere et lite differensialarbeid, der en styrke F produserer en liten DX -forskyvning:
Dw = fdx = padx
Som Adx er nettopp variasjonen av volum Dv, så:
DW = PDV
For å oppnå totalt arbeid i en isotermisk prosess, er DWs uttrykk integrert:
Presset P og volumet V De er grafer i et diagram P-V Som det som er vist på figuren og det utførte arbeidet tilsvarer området under kurven:
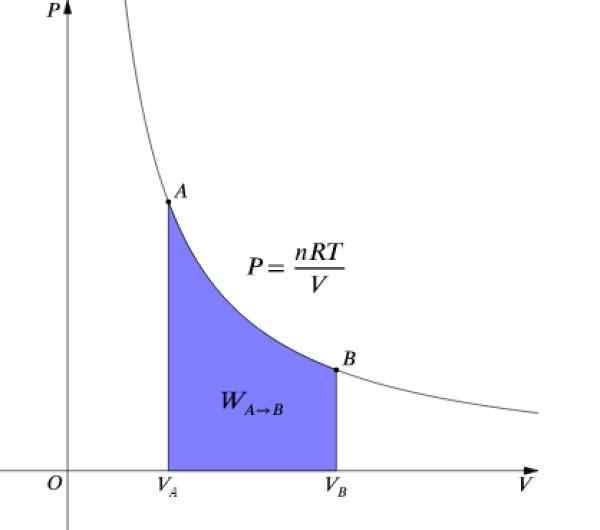 Figur 4. P-V-diagram over en isotermisk prosess. Kilde: Wikimedia Commons.
Figur 4. P-V-diagram over en isotermisk prosess. Kilde: Wikimedia Commons. Som ΔU = 0 Siden temperaturen forblir konstant, i en isotermisk prosess må den:
Q = w
- Oppgave 1
En sylinder utstyrt med et mobilstempel inneholder en ideell gass ved 127 ºC. Hvis stempelet beveger seg til det opprinnelige volumet er redusert 10 ganger, og holder temperaturen konstant, finn mengden føflekker som finnes i sylinderen, hvis arbeidet som er gjort på gassen er 38.180 J.
Faktum: R = 8.3 J/mol. K
Løsning
Uttalelsen bekrefter at temperaturen forblir konstant, da er vi i nærvær av en isotermisk prosess. For arbeidet som er gjort på gassen har du ligningen tidligere trukket:

127 º C = 127 + 273 K = 400 K
N klart, antall føflekker:
N = W / RT LN (V2 / V1) = -38180 J / 8.3 J/mol.K x 400 k x ln (v2/10V2) = 5 føflekker
Et negativt tegn var før jobb. Den imøtekommende leseren vil ha lagt merke til i den foregående delen at W ble definert som "arbeidet utført av systemet" og har et tegn +. Så "arbeidet som er gjort på systemet" har et negativt tegn.
Det kan tjene deg: Andre likevektstilstand: Forklaring, eksempler, øvelser- Oppgave 2
Du har luft i en sylinder utstyrt med et stempel. Opprinnelig er det 0.4 m3 trykk ved 100 kPa og 80 ºC temperatur. Luften komprimeres ved 0.1 m3 sørge for at temperaturen inne i sylinderen forblir konstant under prosessen.
Bestem hvor mye arbeid som gjøres under denne prosessen.
Løsning
Vi bruker ligningen for arbeidet som tidligere er trukket, men antall føflekker er ukjent, som kan beregnes med ligningen på de ideelle gassene:
80 º C = 80 + 273 K = 353 K.
P1V1 = n.R.T → n = p1V1 /RT = 100000 Pa x 0.4 m3 /8.3 J/mol. K x 353 k = 13.65 mol
W = n.R.T ln (v2/V1) = 13.65 mol x 8.3 J/mol. K x 353 k x ln (0.1/0.4) = -55.442.26 J
Igjen indikerer det negative tegnet at arbeidet ble gjort på systemet, noe som alltid skjer når gass er komprimert.
Referanser
- Bauer, w. 2011. Fysikk for ingeniørfag og vitenskap. Volum 1. Mc Graw Hill.
- Cengel, og. 2012. Termodynamikk. 7ma Utgave. McGraw Hill.
- Figueroa, d. (2005). Serier: Fysikk for vitenskap og ingeniørfag. Volum 4. Væsker og termodynamikk. Redigert av Douglas Figueroa (USB).
- Knight, r. 2017. Fysikk for forskere og ingeniørfag: En strategitilnærming.
- Serway, r., Vulle, c. 2011. Fundamentals of Physics. 9na Cengage Learning.
- Wikipedia. Isotermisk prosess. Hentet fra: i.Wikipedia.org.


