Isoamilico alkoholholdig struktur, egenskaper, bruksområder
- 3171
- 806
- Oliver Christiansen
Han Isoamylalkohol Det er en organisk forbindelse hvis formel er (CH3)2Chch2Ch2Åh. Kjemisk sett er en forgrenet primær alkohol, og utgjør en av pentanolisomerer, kalt amylalkoholer (C5H12ENTEN).
Som mange alkoholer med lav molekylvekt er det en fargeløs væske ved romtemperatur. Dette tillater og letter at det brukes som et løsningsmiddel for forskjellige applikasjoner; Når det ikke utøver for mange negative effekter på økosystemet etter å ha kastet.
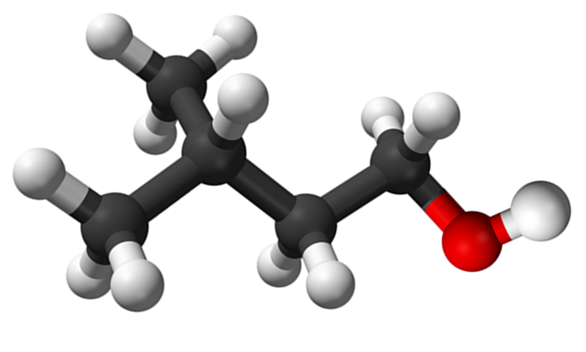
 Isoamilisk alkoholmolekyl. Kilde: Claudio Pistilli de Wikipedia.
Isoamilisk alkoholmolekyl. Kilde: Claudio Pistilli de Wikipedia. Selv om det er et mellomliggende materiale i syntesen av Amilo -acetat for utdyping av banansufter, er dens egen lukt ubehagelig og lik pæren.
I tillegg til å tjene som et løsningsmiddel av flere biologiske stoffer, og som en mellomledd i syntesen av andre acetater, reduserer det overflatespenningen til visse industrielle formuleringer, og forhindrer at skum dannes. Derfor brukes det i mikro -emullerte systemer.
Når det.
[TOC]
Isoamilico -struktur
I det øvre bildet ble isoamylalkoholmolekylet representert med en kuler og barer -modell vist. Til høyre for det samme tilsvarer den rødlige sfæren oksygenatomet i OH -gruppen, karakteristisk for alle alkoholer; Mens du er til venstre, er det det kullsyreholdige skjelettet med en metylgruppe, Cho3, branser strukturen.
Fra et molekylært synspunkt er denne forbindelsen dynamisk for å ha atomer med SP -hybridasjoner3, lette rotasjonen av koblingene deres; Så lenge det ikke får OH og Cho til å formørke3.
Det er også verdt å nevne dets amfifile kjennetegn: den har en apolar eller hydrofob ende, konstituert av kjeden (CH3)2Chch2Ch2-, og et polært eller hydrofilt hode, OH -gruppen. Denne definisjonen av to spesifikke områder med forskjellige polariteter gjør denne alkoholen til en tensaktiv; Og herfra skyldes det søknaden om mikroemulsjoner.
Kan tjene deg: spakregelIntermolekylære interaksjoner
Gitt tilstedeværelsen av OH -gruppen, presenterer det isoamiliske alkoholmolekylet et permanent dipolmoment. Følgelig dipol-dipol.
Mens grenen av hovedkjedene reduserer effektive interaksjoner mellom molekyler, kompenserer hydrogenbroer i denne alkoholen for denne nedstigningen, noe som får væsken til å koke ved 131 ° C, temperaturen høyere enn kokepunktet for vann.
Det skjer ikke med den faste eller "isen", som smelter til -117 ° C, som indikerer at dens intermolekylære interaksjoner ikke er sterke nok til å holde molekylene ordnede; Spesielt hvis CO -gruppen3 som forgrener hovedkjeden forhindrer bedre kontakt mellom molekyler.
Egenskaper
Fysisk utseende
Fargeløs væske.
Lukt og smak
Avviser en ubehagelig lukt som ligner på pæren, og har en skarp smak.
Molmasse
88,148 g/mol.
Tetthet
0,8104 g/ml ved 20 ° C. Det er derfor mindre tett enn vann.
Damptetthet
Det er 3,04 ganger tettere enn luft.
Damptrykk
2,37 mmHg ved 25 ° C.
Kokepunkt
131.1 ° C.
Smeltepunkt
-117.2 ° C.
tenningspunkt
43 ° C (lukket kopp).
Selvordemperatur
340 ° C.
Løselighet
Det er relativt løselig i vann: 28g/l. Dette er fordi de svært polare molekylene i vannet ikke føler spesiell affinitet for den kullsyreholdige isoamylalkoholkjeden. Hvis blandet, vil to faser bli observert: en lavere, tilsvarende vann og en overlegen, den av isoamylalkohol.
I kontrast er det mye mer oppløselig i mindre polare løsningsmidler som: aceton, eter, kloroform, etanol eller iseddik; og til og med i oljeeter.
Det kan tjene deg: Laboratorytermometer: Kjennetegn, hva er det for, bruk, eksemplerGoo
3.738 cp ved 25 ° C.
Overflatespenning
24,77 Dins/cm a 15 ° C.
Brytningsindeks
1.4075 til 20 ° C.
Varmekapasitet
2.382 kJ/g · k.
applikasjoner
Råmateriale
Fra isoamilisk alkohol andre estere, tiofen og medisiner som Amilo -nitritt, validol (isavalerat mentil), Bromisoval (Bromobalerilurea), Corvalol (en innringervann) og Barbamil (Amobarbital) (Amobarbital).
Dufter
I tillegg til å bli brukt til syntese av Amilo -acetat, som har en bananaroma, oppnås også andre fruktdufter som aprikos, appelsiner, plomme, kirsebær og malt fra den. Derfor er det en nødvendig alkohol i utdypingen av mange spiselige eller kosmetikkprodukter.
Antispumant
Ved å redusere overflatespenningen, fremmer den bruken i mikro -emullerte systemer. Praktisk, unngå akselerert bobleformasjon, og reduserer dem i størrelse for å bryte dem.
Det hjelper også bedre å definere grensesnittet mellom vandige og organiske faser under ekstraksjoner; For eksempel blir det lagt til fenol-kloroform-avtrekkblandingen i en 25: 1-andel. Denne teknikken er beregnet på DNA -ekstraksjon.
Ekstraksjoner
Isoamylalkohol lar deg også trekke ut fett eller oljer fra forskjellige prøver, for eksempel melk. Løs også parafinvoks, blekk, gummi, lakk og celluloseestere.
Fortsetter med ekstraksjoner, med det kan du få fosforsyre fra jernfosfatiske mineralløsninger.
Risiko
Lagring og reaktivitet
Som enhver væske som avgir lukt, kan den representere en overhengende risiko for brann hvis stedet der temperaturen er for lagret, enda mer hvis det allerede er en varmekilde.
Under disse forholdene fungerer det ganske enkelt som et drivstoff, fôrer flammene og til og med utnytter beholderen. Når forbrenning, slipp damper som kan påvirke helsen og forårsake kvelning.
Kan tjene deg: Kvantitativ analyse i kjemi: Målinger, forberedelserAndre årsaker til at isoamilisk alkohol er satt i brann, er å blande den eller få den til å reagere med stoffer som: peroksider, brom.
Helse
På kontakt med huden kan du irritere og tørke den ut. Symptomene er imidlertid mer alvorlige hvis det blir inhalert for lenge (hoste, neseforbrenninger, hals og lungene), eller hvis inntatt (hodepine, kvalme, diaré, oppkast, svimmelhet og tap av kunnskap).
Og til slutt, når det søler i øynene irriterer dem og kan til og med skade dem irreversibelt. Heldigvis lar lukten av "alkoholholdige pærer" deg oppdage den i tilfelle flukt eller søl; I tillegg til dette er det en forbindelse som må manipuleres med respekt.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10. utgave.). Wiley Plus.
- Wikipedia. (2019). Isoamylalkohol. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2019). Isoamylalkohol. PubChem -database. CID = 31260. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Zhang Yu & Muhammed Mamoun. (17. september 2008). Ekstraksjon av fosforsyre fra nitratløsninger med isoamylalkohol. Løsningsmiddelekstraksjon og ionutvekslingsvolum 6, 1988 - utgave 6. gjør jeg.org/10.1080/07366298808917973
- New Jersey Department of Health. (2008). Isoamylalkohol. [PDF]. Gjenopprettet fra: NJ.Gov
- Kat Chem. (2019). Isoamylalkohol. Gjenopprettet fra: Kat-Chem.Hu
- Chemoxy International Ltd. (s.F.). Isoamylalkohol. Gjenopprettet fra: Chemoksy.com

