Termisk alkoholstruktur, egenskaper, risikoer og bruk
- 1813
- 310
- Prof. Oskar Aas
Han Termisk alkohol Det er en organisk forbindelse hvis formel er (CH3)3COH eller T-BUOH. Dette er den enkleste tertiære alkoholen av alle. Avhengig av omgivelsestemperaturen presenteres den som en fast eller flytende fargeløs. I det nedre bildet viser de for eksempel deres fargeløse krystaller.
Denne alkoholen er ikke et underlag for enzymet alkoholisk dehydrogenase, eller for den peroksidasiske aktiviteten til katalase, så den er klassifisert som en ikke -metaboliserbar alkohol. På grunn av dets biokjemiske egenskaper, antas det at det kan være nyttig ved påvisning av hydroksiler in vivo i intakte celler.

Det er en av de fire isomerer av isobutilal alkohol, og er den mindre mottagelige isomeren for oksidasjon og den minst reaktive. I naturen finnes det i kikerter og i kassava eller kassava, rot som er gjæret for å produsere alkoholholdige drikker.
Termisk alkohol er veldig løselig i vann og organiske løsningsmidler. Hovedbruken er som et løsningsmiddel, og oppfyller den rollen i utdyping av plast, parfymer, maling av remverses osv.
Som mange organiske forbindelser er det litt giftig, men i høye doser har den en narkotisk effekt, preget av hodepine, vahidos, svimmelhet, svimmelhet og forfall.
[TOC]
Termisk alkoholstruktur
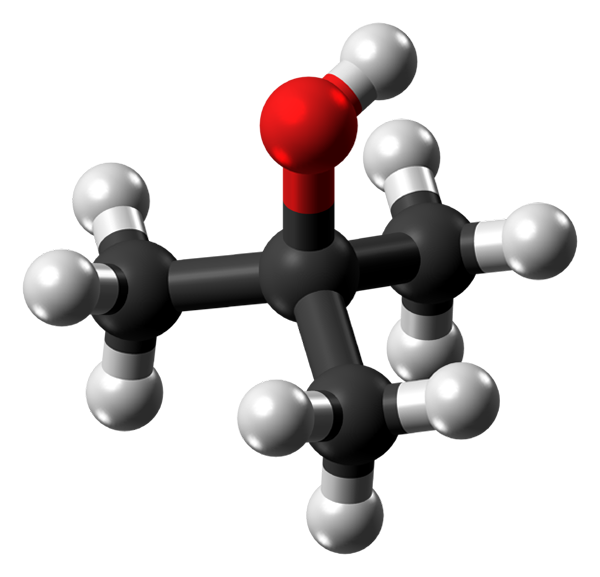
 Termisk alkoholmolekyl. Kilde: Jynto via Wikipedia.
Termisk alkoholmolekyl. Kilde: Jynto via Wikipedia. I det øvre bildet har du molekylstrukturen til termisk alkohol med en modell av kuler og søyler. Hele molekylet har en global tetrahedral geometri, med det tredje karbon som ligger i sentrum, og gruppene3 Og å i toppunktene.
Å observere denne strukturen, er det forstått hvorfor denne alkoholen er tertiær: Karbonet i sentrum er knyttet til tre andre karbonatomer. Fortsetter med tetrahedronen, kan den nedre delen av den betraktes som apolar, mens den øvre toppunktet, polar.
Det kan tjene deg: Fehling -reaksjon: Forberedelser, aktive midler, eksempler, bruksområderI dette toppunktet er OH-gruppen, som skaper en permanent dipol og også lar T-buoh-molekyler samhandle gjennom hydrogenbroer; På samme måte som det gjør med vannmolekyler og andre polare stoffer.
I T-Buah-krystaller er disse hydrogenbroene en nøkkelfaktor for molekylene å forbli sammen; Selv om det ikke er for mye informasjon om hva som er den krystallinske strukturen i denne alkoholen.
Når OH -gruppen er så nær og omgitt av Apolar Groups Cho3, Vannmolekyler klarer å hydrere nesten all alkohol mens du samhandler med OH. Dette vil forklare dens store løselighet i vann.
Egenskaper
Kjemiske navn
-Termisk alkohol
-Ter-butanol
-2- Metyl-2-propanol
-2-metylpropan-2-ol.
Molekylær formel
C4H10O o (cho3)3COH.
Molekylær vekt
74,123 g/mol.
Fysisk beskrivelse
Fargeløs fast eller fargeløs væske, avhengig av omgivelsestemperatur, siden smeltepunktet er 77,9 ºF (25,4 ºC). Over 77,9 ºF er en væske.
Lukt
Ligner på kamferen.
Kokepunkt
82,4 ºC.
Smeltepunkt
77,9 ºF (25,4 ºC).
tenningspunkt
52 ºF (11 ºC). Lukket kopp.
Vannløselighet
Veldig løselig. Uansett proporsjoner er denne alkoholen alltid blandbar med vann.
Løselighet i organiske løsningsmidler
Blandbar med etanol, etyleter og oppløselig i kloroform.
Tetthet
0,78 g/cm3.
Damptetthet
2,55 (med luftforhold = 1).
Damptrykk
4.1 kPa ved 20 ºC.
Oktanol/vannpartisjonskoeffisient
Logg P = 0,35.
Termostabilitet
Ustabil i varmen
Selvretningstemperatur
896 ºF (470 ºC).
Kan tjene deg: alikvot (kjemi)Nedbrytning
Når oppvarmet kan frigjøre karbon- og isobutilenmonoksiddamp.
Fordampningsvarme
39.07 kJ/mol.
Kalorikapasitet
215,37 JK-1mol-1.
Trening entalpi
-360.04 til -358.36 KJMOL-1.
Lager temperatur
2-8 ºC.
Stabilitet
Det er stabilt, men uforenlig med sterke oksidasjonsmidler, kobber, kobberlegeringer, alkaliske og aluminiumsmetaller.
Ioniseringspotensial
9.70 EV.
Lukt terskel
219 mg/m3 (lav lukt).
Brytningsindeks
1.382 til 25 ° C.
Dissosiasjonskonstant
PKA = 19,20.
Maksimal dampkonsentrasjon
5,53 % ved 25 ºC.
Reaksjoner
-Det er ubehagelig av en sterk base å forårsake en alcoxide -anion; Spesifikt et terbutoksyd, (CH3)3Co-.
-Termisk alkohol reagerer med hydrogenklorid for å danne terbutylklorid.
(Ch3)3COH +HCl => (CH3)3CCL +H2ENTEN
Tertiære alkoholer har større reaktivitet med hydrogenhalogenider enn sekundære og primære alkoholer.
Risiko
Termisk alkohol ved kontakt med huden produserer milde lesjoner, for eksempel erytem og ikke -alvorlig hyperemi. I tillegg krysser den ikke huden. Tvert imot, i øynene gir det alvorlig irritasjon.
Når det blir inhalert, produserer det irritasjon i nesen, halsen og bronkiene. Ved høy eksponering kan narkotiske effekter, en døsighetstilstand, samt blekner, vahidoer og hodepine oppstå.
Denne alkoholen er et eksperimentelt teratogent middel, så det har blitt observert hos dyr som kan påvirke utseendet til medfødte lidelser.
Når det gjelder lagring, er væsken og damper brennbar, og derfor kan den under visse omstendigheter generere branner og eksplosjoner.
OSHA etablerte en konsentrasjonsgrense på 100 ppm (300 mg/m3) I en 8 -timers dag.
Kan tjene deg: Prosentvis løsningerapplikasjoner
-Termisk alkohol brukes til inkorporering av den termiske gruppen i organiske forbindelser, for å fremstille oppløselige oljer i oljer, og trinitro-tter-buutletoluen, en kunstig musk. I tillegg utgjør det et første materiale for fremstilling av peroksider.
-Det er godkjent av FDA som et spligemiddel å bruke i komponenter og plastmaterialer som er i kontakt med mat. Det har blitt brukt i utdyping av frukt, plast og lacas -essenser.
-Det er en mellomledd for produksjon av terbutyl og tributilfenolklorid. Det fungerer som et denaturerende middel for etanol.
-Server for fremstilling av flotasjonsmidler, som et organisk løsningsmiddel for å fjerne malerier, og for å oppløse essenser brukt i parfymer.
-Den brukes som en oktanforsterker i bensin; Drivstoff- og drivstofftilsetningsstoff; Løsningsmiddel som skal brukes i rengjøring og som en elendig.
-Termisk alkohol er et mellomliggende middel i produksjonen av terbutylmetyleter (MTBE) og tributiletyleter (ETBE), og reagerer henholdsvis med metanol og etanol.
-Det virker også på samme måte i produksjonen av tributylhydroperoksid (TBHP) ved reaksjon med hydrogenperoksyd.
-Det brukes som et reagens i prosessen kjent som Curtius Rearreglo.
Referanser
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10th Utgave.). Wiley Plus.
- Wikipedia. (2019). Tert-butylalkohol. Hentet fra: i.Wikipedia.org
- Commonorganicchemistry. (s.F.). T-Butanol. Gjenopprettet fra: CommonorganicChemistry.com
- Nasjonalt senter for bioteknologiinformasjon. (2019). Tert butanol. PubChem -database. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Carey f. TIL. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- « Holdningsinnhold Karakteristikker og eksempler
- Hva skal barn og unge fra det 21. århundre lære å handle i dagens verden? »

