Alfa Amilasa -egenskaper, struktur, funksjoner
- 3404
- 900
- Daniel Skuterud
De Alfa Amilasa (α-amylase) er et ammilolitisk enzym av Endo Amilasas-gruppen som er ansvarlig for hydrolyse av a-1,4 bindinger mellom glukoserestene som utgjør forskjellige typer karbohydrater i naturen i naturen i naturen i naturen i naturen.
Systematisk kjent som systematisk kjent som α-1,4-glukan. Hos mennesker, for eksempel, er amylasene som er til stede i spytt og de som utskilles av bukspyttkjertelen av a-amylaser-type.
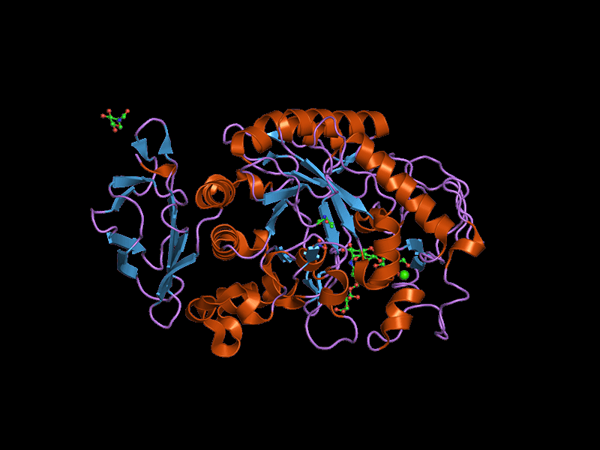
 C-terminal domenestruktur av Alfa Amilasa-dyret (Kilde: Jawahar Swaminathan og MSD-ansatte ved European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons)
C-terminal domenestruktur av Alfa Amilasa-dyret (Kilde: Jawahar Swaminathan og MSD-ansatte ved European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) Kuhn, i 1925, var den første som mynter begrepet "a-amylase" basert på det faktum at produktene fra hydrolyse som katalyserer disse enzymene har konfigurasjon α. Senere, i 1968 ble det bestemt at disse fortrinnsvis virker på lineære og ikke -forgrenede strukturelle konfigurasjonssubstrater.
Som andre ammilitiske enzymer, er a-amylase ansvarlig for hydrolyse av stivelsen og andre relaterte molekyler som glykogen, og produserer mindre polymerer sammensatt av gjentatte enheter av glukose.
I tillegg til de fysiologiske funksjonene som dette enzymet har hos dyr, planter og mikroorganismer som uttrykker det, representerer a-amylase, sammen med de andre klassene av eksisterende amylaser, 25% av enzymer som brukes til industrielle og bioteknologiske formål.
Mange arter av sopp og bakterier er den viktigste kilden til å oppnå α-amylaser som brukes oftere i industri og vitenskapelig eksperimentering. Dette skyldes hovedsakelig dens allsidighet, det er enkelt å oppnå, dens enkle styring og de lave kostnadene relatert til produksjonen.
[TOC]
Kjennetegn
A-amylasene som finnes i naturen kan ha optimale pH-områder av veldig forskjellig pH for dens drift; For eksempel er optimal for α-amylaser dyr og plante mellom 5.5 og 8.0 pH -enheter, men noen bakterier og sopp har flere alkaliske enzymer og flere syrer.
Kan tjene deg: fylogeniEnzymene som er til stede i spytt og pattedyrbukspyttkjertel fungerer bedre på pH nær 7 (nøytral) i tillegg, de krever kloridioner for å oppnå sin maksimale enzymatiske aktivitet og er i stand til å slå sammen divalente kalsiumioner.
Både dyr, spytt- og bukspyttkjertelenzymer produseres i organismer av uavhengige mekanismer som involverer spesifikke celler og kjertler, og som sannsynligvis ikke er relatert til enzymer som er til stede i sirkulasjonsstrømmen og andre kroppshulrom.
Både pH og den optimale temperaturen for funksjonen til disse enzymene avhenger sterkt av fysiologien til organismen som blir vurdert, siden det er ekstremofile mikroorganismer som vokser under veldig spesielle forhold med hensyn til disse og mange andre parametere.
Til slutt, med tanke på reguleringen av dens aktivitet, er en egenskap som deles mellom enzymene til gruppen av a-amylaser at disse, som andre amylaser, kan hemmeres av tungmetallioner som kvikksølv, kobber, sølv og bly.
Struktur
A-amylase er et multidominiumenzym som hos dyr og planter har en omtrentlig molekylvekt på 50 kDa og forskjellige forfattere er enige om at enzymer som tilhører denne familien av glykodhydrolesase er enzymer med mer enn ti strukturelle domener.
Det sentrale domenet eller det katalytiske domenet er veldig bevart og er kjent som domene A, som består av en symmetrisk fold på 8 ß-belagte ark arrangert i form av en "tønne" som er omgitt av 8 alfa-hall, slik at du også kan finne I litteratur hvordan (β/α) 8 eller "tim" type tønne.
Det er viktig å merke seg at ved den C-terminale enden av β-arkene av domene A er det bevarte aminosyreavfallet som er involvert i katalyse og i krysset mellom underlaget, og at dette domenet er lokalisert i den N-terminale regionen av proteinet.
Det kan tjene deg: Fauna og flora i det peruanske havEt annet av de mest studerte domenene til disse enzymene er den såkalte Ding B, som skiller seg ut mellom den β-pelte laminaen og alfa nummer 3-propellen til domenet a. Dette spiller en grunnleggende rolle i foreningen av underlag og divalent kalsium.
Ytterligere domener er beskrevet for α-amylassenzymer, for eksempel domenene C, D, F, G, H og I, som er plassert foran eller baksiden av domenet A og hvis funksjoner ikke er kjent nøyaktig og avhenger av organismen som at det studeres.
α-amylaser av mikroorganismer
Molekylvekten til a-amylaser avhenger, så vel som andre biokjemiske og strukturelle egenskaper, på organismen som er studert. Dermed har a-amylasene til mange sopp og bakterier vekter så lave som 10 kDa og så høye som 210 kDa.
Den høye molekylvekten til noen av disse mikrobielle enzymene er ofte relatert til tilstedeværelsen av glykosilering, selv om glykosylering av protein i bakterier er ganske sjelden.
Funksjoner
Hos dyr er α-amylaser ansvarlige for de første trinnene i metabolismen av stivelse og glykogen, ettersom de er ansvarlige for hydrolyse til mindre fragmenter. Organene i det gastrointestinale systemet med ansvar for deres produksjon hos pattedyr er bukspyttkjertelen og spyttkjertlene.
I tillegg til dens åpenbare metabolske funksjon, blir produksjonen av a-amylaser produsert av spyttkjertlene til mange pattedyr, aktivert av noradrenalinhandling, av mange forfattere betraktet som en viktig "psykobiologisk" stressmarkør i stresset i det sentralnervesystemet.
Den har også sekundære funksjoner ved oral helse, ettersom aktiviteten fungerer i eliminering av orale bakterier og i forebygging av dens vedheft til orale overflater.
Det kan tjene deg: Sympatrisk spesifikasjon: Konsept, egenskaper og eksemplerHovedfunksjon i planter
Hos planter spiller α-amylaser en primær rolle i spiring av frø, ettersom de er enzymene som hydrolyserer stivelsen som er til stede i endospermen som gir næring til embryoet inne, prosesser i det vesentlige kontrollert av Gibberelin, et fytormon.
Industrielle applikasjoner
Enzymer som tilhører familien av α-amylaser har flere applikasjoner i mange forskjellige sammenhenger: industrielt, vitenskapelig og bioteknologisk, etc.
I store stivelsesforedlingsindustrier brukes α-amylaser populært til glukose- og fruktoseproduksjon, så vel som for produksjon av brød med forbedrede teksturer og med større lojal kapasitet.
I det bioteknologiske feltet eksisterer det mye interesse for forbedring av enzymene som er kommersielt brukt, for å forbedre deres stabilitet og ytelse under forskjellige forhold.
Referanser
- Aiyer, p. V. (2005). Amylaser og deres applikasjoner. African Journal of Biotechnology, 4(13), 1525-1529.
- Bernfeld, p. (1960). Amylaser, a og b. I Enzymer av karbohydratmetabolisme (Vol. I, s. 149-158).
- Granger, d. TIL., Kivighan, k. T., M., Gordis, e. B., & Stud, l. R. (2007). Spytta A-Andlase i Biobehavioral Research. Nyere utvikling og applikasjoner. Ann. N.OG. Acade. Sci., 1098, 122-144.
- Monteiro, p., & Oliveira, P. (2010). Anvendelse av mikrobiell A-Andlase i bransjen- en gjennomgang. Brazilian Journal of Microbiology, 41, 850-861.
- Reddy, n. S., Nimmagadda, a., & Rao, k. R. S. S. (2003). En oversikt over den mikrobielle α-kjærlighetsfamilien. African Journal of Biotechnology, 2(12), 645-648.
- Salt, w., & Shenker, S. (1976). Amylase- dens kliniske betydning: en gjennomgang av litteraturen. Medisin, 55(4), 269-289.
- Svensson, f., & MacGregor, og. TIL. (2001). Forholdet mellom sekvens og struktur til spesifisitet i a-amylase-familien av enzymer. Biochimica et Biophysica Acta, 1546, 1-20.
- Thoma, J. TIL., Spradlin, J. OG., & Dygert, S. (1925). Plante- og dyremylaser. Ann. Chem., 1, 115-189.
- « Reninstruktur, produksjon, sekresjon, funksjoner
- Urie Bronfenbrenner biografi, økologisk modell og bidrag »

