Amfotere som er, typer og eksempler
- 1093
- 131
- Markus Fredriksen
De Amfostterere De er forbindelsene eller ionene som har særegenheten til å kunne oppføre seg som en syre eller som en base, ifølge Bronsted and Lowry -teorien. Hans navn kommer fra det greske ordet Amphoteroi, som betyr "begge deler".
Mange metaller danner amfoterosoksider eller hydroksider, inkludert kobber, sink, tinn, bly, aluminium og beryllium. Amfoteren som er karakteristisk for disse oksydene, avhenger av oksidasjonstilstandene til oksydet det gjelder spørsmål. På slutten av artikkelen er eksempler på disse stoffene inkludert.

Metalloksider som kan reagere med syrer og baser for å produsere salter og vann er kjent som amfoterosoksider. Bly- og sinkoksider er veldig gode eksempler, blant andre forbindelser.
[TOC]
Hva er amfoteren?
I følge Bronsted og Lowrys syre-base-teori er syrer de stoffene som donerer protoner, mens basene er de som aksepterer eller tar protonene.
Et molekyl kalt amfotat vil ha reaksjoner der det skaffer seg protoner, da det også vil ha muligheten til å donere dem (selv om det ikke alltid er slik, som det vil bli sett i neste avsnitt).
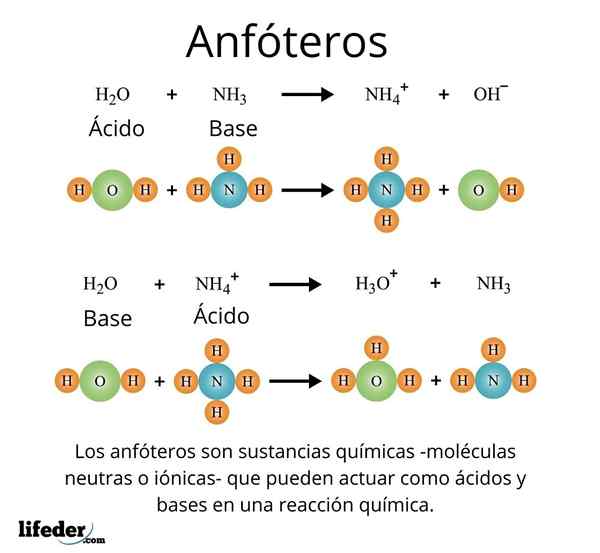
En viktig og godt anerkjent sak er det av universaloppløsningsmidlet, vann (H₂O). Dette stoffet reagerer lett med syrer, for eksempel som reaksjon med saltsyre:
H2O + HCl → H3ENTEN+ + Cl-
Men på sin side har han heller ikke problemer med å reagere med en base, som for ammoniakk:
H2O + NH3 → NH4 + Åh-
Med disse eksemplene kan det observeres at vann fungerer fullt ut som et amfotatstoff.
Typer amfotere
Selv om amfotente stoffer kan være molekyler eller ioner, er det molekyler som best viser de amfotente egenskapene og hjelper til med å studere denne oppførselen bedre: amfrofrotiske stoffer. Dette er molekyler som spesifikt kan donere eller akseptere et proton for å fungere som syre eller base.
Kan tjene deg: Rodio: Historie, egenskaper, struktur, bruk, risikoDet må avklares at alle amfotiske stoffer er amfotiske, men ikke alle amfotere er amfiprtiske; Det er amfotoros som ikke har protoner, men de kan oppføre seg som syrer eller baser på andre måter (for eksempel Lewis teori).
Blant de amfiprtiske stoffene er vann, aminosyrer og bikarbonat- og sulfationer. På sin side blir amfrofotiske stoffer også underklassifisert i henhold til deres evne til å donere eller gi protoner:
Protogene eller amfiprytinsyrestoffer
Er de som har en større tendens til å gi et proton enn å akseptere en. Blant disse er svovelsyre (h2SW4) og eddiksyre (Cho3Cooh), blant andre.
Grunnleggende protofile eller amfotiske stoffer
De er de som å akseptere et proton er mer vanlig enn å gi det. Blant disse stoffene kan du finne ammoniakk (NH3) og etylendiamid [C2H4(NH2)2].
Nøytrale stoffer
De har samme letthet eller evne til å godta et proton som å gi det opp. Blant disse er vann (h2O) og mindre alkoholer (-roh), hovedsakelig.
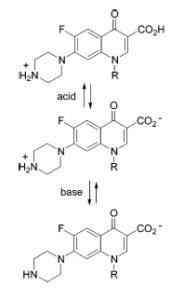 Ampotero karakter av kinoloner
Ampotero karakter av kinoloner Eksempler på amfotente stoffer
 Amphotero spenning
Amphotero spenning Nå beskrev du allerede de amfotente stoffene det er nødvendig å betegne eksemplene på reaksjoner der disse egenskapene blir presentert.
Ionet av kullsyre presenterer et grunnleggende tilfelle av et amfiprtisk stoff; Da blir reaksjonene deres representert når den fungerer som en syre:
HCO3- + Åh- → co32- + H2ENTEN
Den neste reaksjonen oppstår når den fungerer som en base:
HCO3- + H3ENTEN+ → H2Co3
Det er også mange andre stoffer. Av disse er følgende eksempler:
Amfoterosoksider
Sinkoksid, som allerede nevnt, er en amfotero, men ikke et amfiprtisk stoff. Deretter demonstreres det hvorfor.
Kan tjene deg: Justus von LiebigOppfører seg som syre:
ZnO + H2SW4 → ZnSO4 + H2ENTEN
Oppfører seg som base:
ZnO + 2NaOH + H2O → Na2[Zn (OH)4]
Blyoksid (PBO), aluminium (Al2ENTEN3) og tinn (SNO) har også sine egne amfotente egenskaper:
Oppfører seg som syrer:
PBO + 2HCL → PBCL2 + H2ENTEN
Til2ENTEN3 + 6HCl → 2Alcl3 + 3H2ENTEN
Sno + HCl ↔ Sncl + H2ENTEN
Og som baser:
PBO + 2NAOH + H2O → Na2[PB (OH)4]
Til2ENTEN3 + 2naoh + 3H2O → 2na [al (OH)4]
Sno + 4Naoh + H2Eller ↔ na4[SN (OH)6]
Det er også amfoterosoksider fra Gallia, Indian, Scandio, Titanium, Circonium, Vanadium, krom, jernet, kobolt, kobber, sølv, gull, Germanio, antimon, vismut og Telurio.
Anfoterhydroksider
Hydroksider kan også presentere amfotente egenskaper, for eksempel i tilfeller av aluminiumhydroksyd og beryllium. Begge eksemplene er observert nedenfor:
Aluminiumhydroksyd som syre:
Al (å)3 + 3HCl → ALCL3 + 3H2ENTEN
Aluminiumhydroksyd som base:
Al (å)3 + NaOH → Na [Al (OH)4]
Berylliumhydroksyd som syre:
Være (å)2 + 2HCl → Becl2 + H2ENTEN
Berylliumhydroksyd som base:
Være (å)2 + 2naoh → Na2[Være (å)4]
Forskjeller mellom amfoteros, amfiprtiske, amfolitter og apratikk
Det er nødvendig å vite hvordan man kan differensiere begrepet hvert begrep, siden dets likhet kan bli forvirrende.
Det er kjent at amfotoros er stoffer som oppfører seg som syrer eller baser i en reaksjon som produserer et salt og vann. De kan gjøre dette for donasjon eller fangst av et proton, eller bare ved å akseptere et elektronisk dreiemoment (eller gi det) i henhold til Lewis teori.
På den annen side er amfotiske stoffer de amfoterne som fungerer som syrer eller baser med donasjon eller innsamling av et proton, ifølge Bronsted-Lowrys lov. Alle amfotiske stoffer er amfotiske.
Kan tjene deg: Benzoine: Struktur, egenskaper, bruksområderAmpolitiske forbindelser er amfotente molekyler som eksisterer som zwitterions og har dipolioner i visse ph. De brukes som dempemidler i bufferløsninger.
Endelig er klemløsningsmidlene de som ikke har protoner å gi etter og ikke kan akseptere dem heller.
Referanser
- Amfoterisk. (2008). Wikipedia. Hentet fra IN.Wikipedia.org
- Anne Marie Helmestine, P. (2017). Hva betyr amfoterisk i kjemi?. Hentet fra Thoughtco.com
- Bicpuc. (2016). Amfoteriske forbindelser. Hentet fra medum.com
- Chemicool. (s.F.). Definisjon av amfoterisk. Hentet fra Chemicool.com.
- « Den mest populære typiske Colombia
- Valg av temaet forskning Hvordan, viktighet, eksempler gjøres »

