Anhydrider

- 4361
- 837
- Markus Fredriksen
Hva er anhydrider?
De Anhydrider De er kjemiske forbindelser som stammer fra forening av to molekyler ved frigjøring av vann. Dermed kan det sees på som en dehydrering av de første stoffene; Selv om det ikke er nettopp sant.
I organisk og uorganisk kjemi er de nevnt, og i begge grener er deres forståelse forskjellig i betydelig grad. For eksempel regnes for eksempel i uorganisk kjemi som basiske og syreoksider som anhylkoblinger av henholdsvis hydroksider og syrer, siden førstnevnte reagerer med vann for å danne den andre.
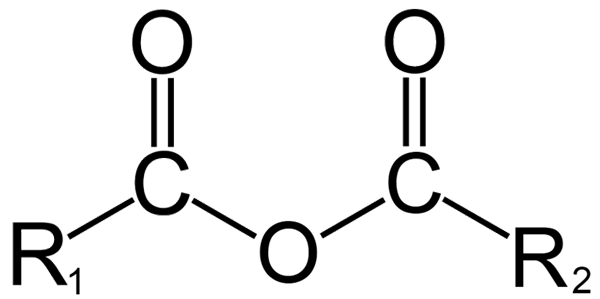 Generell struktur av anhydrider. Kilde: DremmetBrownie [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)], fra Wikimedia Commons
Generell struktur av anhydrider. Kilde: DremmetBrownie [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)], fra Wikimedia Commons Her kan en forvirring mellom begrepene 'vannfri' og 'anhydrido' genereres. Generelt refererer vannfritt til en forbindelse som den har blitt dehydrert uten endringer i dens kjemiske natur (det er ingen reaksjon); Mens det er med anhydrid, er det en kjemisk endring, gjenspeiles i molekylstrukturen.
Hvis de tilsvarende hydroksider og syrer (eller anhydrider) blir sammenlignet, vil det bli observert at det var en reaksjon. På den annen side kan noen oksider eller salter være hydrert, miste vann og fortsette å være de samme forbindelsene; Men uten vann, det vil si Anhydros.
I organisk kjemi, derimot, er det som forstås av anhydrid den første definisjonen. For eksempel er et av de mest kjente anhydridene de som er avledet fra karboksylsyrer (overlegen bilde). Disse består av forening av to acylgrupper (-RCO) gjennom et oksygenatom.
I sin generelle struktur er r indikert1 For en acylgruppe, og r2 For den andre Acilo -gruppen. Fordi r1 og r2 De er forskjellige, kommer fra forskjellige karboksylsyrer, og så er det en asymmetrisk syreanhydrid. Når begge substituenter r (enten aromatisk) er de samme, er det snakk i så fall av et symmetrisk syreanhydrid.
På tidspunktet for å koble to karboksylsyrer for å danne anhydrid, kan vann eller ikke dannes, så vel som andre forbindelser. Alt vil avhenge av strukturen til disse syrene.
Anhydridegenskaper
Egenskapene til anhydrider vil avhenge av hvilken som refererer til. Nesten alle har til felles at de reagerer med vann. For de så -kalt basiske anhydrider i uorganiske er imidlertid flere av dem til og med uoppløselige i vann (MGO), så denne uttalelsen vil fokusere på anhydridene til karboksylsyrer.
Fusjons- og kokepunkter faller på molekylstrukturen og intermolekylære interaksjoner for (RCO)2Eller, dette er den generelle kjemiske formelen til disse organiske forbindelsene.
Hvis molekylmassen til (RCO)2Eller det er lavt, det er sannsynligvis en fargeløs væske ved romtemperatur og trykk. For eksempel eddikanhydrid (eller ehydridge3Co)2Eller, det er en væske og den viktigste industrielle viktigheten, og produksjonen er veldig enorm.
Reaksjonen mellom eddik anhydrid og vann er representert ved følgende kjemiske ligning:
(Ch3Co)2Eller + h2O => 2ch3COOH
Legg merke til at når vannmolekylet tilsettes, frigjøres to eddiksyremolekyler. Omvendt reaksjon kan imidlertid ikke forekomme for eddiksyre:
Kan tjene deg: væskedampbalanse2ch3COOH => (Cho3Co)2Eller + h2Eller (skjer ikke)
Det er nødvendig å ty til en annen syntetisk rute. Dikarboksylsyrer kan derimot gjøre det ved oppvarming; Men det vil bli forklart i neste avsnitt.
Kjemiske reaksjoner
Hydrolyse
En av de enkleste reaksjonene av anhydrider er deres hydrolyse, som nettopp har blitt vist for eddisk anhydrid. I tillegg til dette eksemplet, er det av svovelsyreanhydrid:
H2S2ENTEN7 + H2Eller 2H2SW4
Her har du en uorganisk syreanhydrid. Legg merke til at for h2S2ENTEN7 (også kalt disulfurinsyre), er reaksjonen reversibel, så oppvarming h2SW4 Konsentrat resulterer i dannelsen av anhydrid. Hvis det derimot er en utvannet løsning av H2SW4, Det er utgitt så3, Svovisk anhydrid.
Forestring
Syreanhydrider reagerer med alkoholer, med pyridin i midten, for å gi opphav til en ester og en karboksylsyre. For eksempel vurderes reaksjonen mellom eddik anhydrid og etanol:
(Ch3Co)2Eller + ch3Ch2Oh => cho3Co2Ch2Ch3 + Ch3COOH
Dermed danner etyletanesteren, CH3Co2Ch2Ch3, og etansyre (eddiksyre).
Praktisk talt, det som skjer er erstatning av hydroksylgruppen, av en Aquilus -gruppe:
R1-Oh => r1-OCOR2
I tilfelle av (ch3Co)2Eller, din acilo -gruppe er -coch3. Derfor sies det at OH -gruppen gjennomgår acilatisering. Aksisjon og forestring er imidlertid ikke utskiftbare konsepter; Akilasjon kan forekomme direkte i en aromatisk ring, kjent som Friedel-Crafts Acilation Name.
Dermed blir alkoholer i nærvær av syreanhydrider forestret ved acilatisering.
På den annen side er det bare en av de to syregruppene som reagerer med alkohol, den andre holder seg med hydrogen som danner en karboksylsyre; det i tilfelle av (cho3Co)2Eller det er etansyre.
Amidasjon
Syreanhydrider reagerer med ammoniakk eller aminer (primær og sekundær), for å gi opphav til amider. Reaksjonen er veldig lik den nybeskrevne forestringen, men ROH erstattes av en amin; For eksempel en sekundær amina, r2NH.
Igjen, reaksjonen mellom (CH3Co)2Eller og dietylamin, ET2Nh:
(Ch3Co)2O + 2et2NH => CH3Forts2 + Ch3COO- +NH2Et2
Og diethilacetamid er dannet, cho3Forts2, og et karboksylert ammoniumsalt, CHO3COO- +NH2Et2.
Selv om ligningen kan virke litt vanskelig å forstå, er det nok å observere hvordan gruppen -coch3 Bytt ut H for en ET2NH for å danne amida:
Et2Nh => et2NCOCH3
Mer enn en amidasjon er reaksjonen fortsatt acilatisering. Alt er oppsummert i det ordet; Denne gangen lider aminaen acilatisering og ikke alkohol.
Hvordan er anhydrider?
Uorganiske anhydrider dannes ved å reagere elementet med oksygen. Således, hvis elementet er metallisk, dannes et grunnleggende metallisk oksyd; Og hvis det ikke er metallisk, dannes et ikke -metallisk oksid eller syreanhydrid.
Det kan tjene deg: Clausius-Clapeyron-ligning: Hva er det for, eksempler, øvelserFor organiske anhydrider er reaksjonen en annen. To karboksylsyrer kan ikke slå seg direkte for å frigjøre vann og danne anhydridsyre; Deltakelse av en forbindelse som ennå ikke er nevnt: acylklorid, rcocl er nødvendig.
Karboksylsyre reagerer med surt klorid, og produserer det respektive anhydrid og hydrogenklorid:
R1COCL + R2COOH => (r1Co) eller (cor2) + HCl
Ch3COCL + CH3COOH => (Cho3Co)2O + HCl
En ch3 kommer fra acetylgruppen, cho3Co-, og den andre er allerede til stede i eddiksyre. Valget av en spesifikk syreklorid, så vel som karboksylsyre, kan gi opphav til syntese av en symmetrisk eller asymmetrisk syreanhydrid.
Sykliske anhydrider
I motsetning til de andre karboksylsyrene som krever syreklorid, kan dikarboksylsyrer kondensere i sitt tilsvarende anhydrid. For å gjøre dette er det nødvendig å varme dem opp for å fremme frigjøring av H2ENTEN. For eksempel er dannelsen av ftalisk anhydrid vist fra fotalsyre.
 Ftalisk anhydriddannelse. Kilde: Jü [Public Domain], fra Wikimedia Commons
Ftalisk anhydriddannelse. Kilde: Jü [Public Domain], fra Wikimedia Commons Legg merke til hvordan den femkantede ringen er fullført, og oksygenet som blir sammen med begge gruppene C = O er en del av den; Dette er et syklisk anhydrid. Det kan også sees at den ftaliske anhydridet er et symmetrisk anhydrid, siden så mye r1 som r2 De er identiske: en aromatisk ring.
Ikke alle dikarboksylsyrer er i stand til å danne anhydridet, siden når deres COOH -grupper er veldig atskilt, blir de tvunget til å fullføre stadig større ringer. Den største ringen som kan dannes er en sekskantet, større enn at reaksjonen ikke finner sted.
Nomenklatur
Hvordan heter anhydrider? Forlater det uorganiske, relevante for oksydproblemer, er navnene på organiske anhydrider så langt forklart av identiteten til r1 og r2; det vil si av sine acylgrupper.
Hvis de to R er de samme, er det nok å erstatte ordet 'syre' med 'anhydrid' i det respektive navnet på karboksylsyre. Og hvis de tvert imot er de to r forskjellige, er de navngitt i alfabetisk rekkefølge. For å vite hvordan du skal kalle det, må du derfor se først hvis det er en symmetrisk eller asymmetrisk anhydrid.
Ch3Co)2Eller det er symmetrisk, siden r1= R2 = Ch3. Den stammer fra eddik eller etansyre, så navnet etter den forrige forklaringen: eddik eller etanoisk anhydrid. Det samme skjer med det ftaliske anhydridet nettopp nevnt.
Anta at du har følgende anhydrid:
Ch3Co (o) coch2Ch2Ch2Ch2Ch2Ch3
Acetylgruppen til venstre kommer fra eddiksyre, og den til høyre, fra heptansyre. For å nevne dette anhydridet må du utnevne R -gruppene i alfabetisk rekkefølge. Så han heter: heptanisk eddik anhydrid.
applikasjoner
Uorganiske anhydrider har uendelige anvendelser, fra syntese og formulering av materialer, keramikk, katalysatorer, sement, elektroder, gjødsel, etc., Inntil som belegg av jordskorpen med sine tusenvis av jern- og aluminiumsmineraler, og karbondioksidet som er utpustet av levende organismer.
Kan tjene deg: dekantasjon: konsept, eksempler og typerDe representerer startkilden, punktet der mange forbindelser som brukes i uorganisk syntese stammer. Et av de viktigste anhydridene er den av Carbonic, CO2. Det er sammen med vannet viktig for fotosyntesen. Og på industrielt nivå, SO3 Det er viktig siden den tiltalte svovelsyre oppnås fra den.
Kanskje er anhydrid med flere anvendelser og for å ha (så lenge det er liv) en fra fosforsyre: adenosin -tryposfat, bedre kjent som ATP, til stede i DNA og "energivaluta" i metabolismen.
Organiske anhydrider
Syreanhydrider reagerer gjennom acylering, enten til en alkohol, og danner en ester, en amin, og gir opphav til en amida eller en aromatisk ring.
Det er millioner av hver av disse forbindelsene, og hundretusener av karboksylsyrealternativer for å fremstille et anhydrid; Derfor vokser syntetiske muligheter drastisk.
Dermed er en av hovedapplikasjonene å innlemme en syregruppe i en forbindelse, og erstatte et av atomene eller gruppene i dens struktur.
Hver dioksid separat har sine egne applikasjoner, men generelt reagerer de alle på en lignende måte. Av den grunn brukes denne typen forbindelser for å modifisere polymerstrukturer, og skape nye polymerer; Det vil si kopolymerer, harpikser, belegg osv.
For eksempel brukes eddiksanhydrid til å acetillere alle cellulose OH -grupper (lavere bilde). Med dette erstattes hver H av OH av en acetylgruppe, coch3.
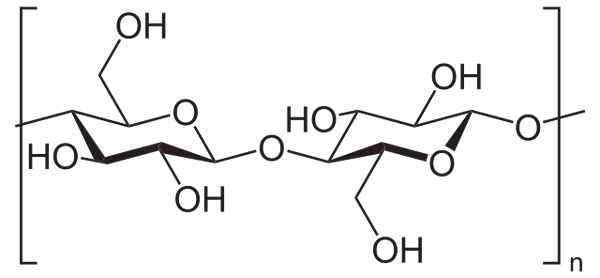 Cellulose. Kilde: Neurotoger [Public Domain], fra Wikimedia Commons
Cellulose. Kilde: Neurotoger [Public Domain], fra Wikimedia Commons På denne måten oppnås celluloseacetatpolymeren. Den samme reaksjonen kan skisseres med andre polymerstrukturer med NH -grupper2, Også mottakelig for acilatisering.
Disse acilatasjonsreaksjonene er også nyttige for medikamentsyntese, for eksempel aspirin (syre acetylsalisyl).
Eksempler
De er vist å fullføre noen andre eksempler på organiske anhydriper. Selv om de ikke vil nevne dem, kan oksygenatomer erstattes av svovel, og gir sulfurisert anhydrider, eller til og med fosfor.
-C6H5CO (O) Cook6H5: Benzoisk anhydrid. Gruppe c6H5 representerer en benzenring. Hydrolysen produserer to benzosyrer.
-HCO (O) COH: Mak Anhydrid. Hydrolysen produserer to maursyrer.
- C6H5Co (o) coch2Ch3: Propanisk benzoisk anhydrid. Hydrolysen produserer benzoiske og propansyrer.
-C6HelleveCO (O) Cook6Helleve: Cyclohexanocroboxylicanight Anhydrid. I motsetning til aromatiske ringer, er disse mettede, uten doble lenker.
-Ch3Ch2Ch2Co (o) coch2Ch3: Propanisk butanisk anhydrid.
Succinic Anhydride
 Succinic Anhydride. Kilde: Ninjatacoshell [Public Domain], fra Wikimedia Commons
Succinic Anhydride. Kilde: Ninjatacoshell [Public Domain], fra Wikimedia Commons Her har du en annen syklisk, avledet fra ravsyre, en dikarboksylsyre. Legg merke til at de tre oksygenatomene forråder den kjemiske naturen til denne typen forbindelse.
Anhydrid Maleico er veldig likt den som rygger, med forskjellen at det er en dobbeltbinding mellom karbonene som danner basen til Pentagon.
Glutarisk anhydrid
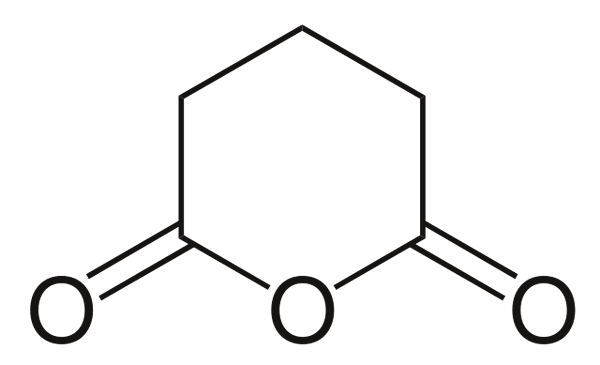 Glutarisk anhydrid. Kilde: Choij [Public Domain], fra Wikimedia Commons
Glutarisk anhydrid. Kilde: Choij [Public Domain], fra Wikimedia Commons Og til slutt vises anhydrid av glutarsyre. Dette skiller strukturelt alle andre ved å bestå av en sekskantet ring. Igjen skiller de tre oksygenatomene seg ut i strukturen.
Andre mer komplekse anhydrider kan alltid bevises av de tre oksygenatomene veldig nær hverandre.
Referanser
- Anhydrid. Enclyclopaedia Britannica. Gjenopprettet fra: Britannica.com
- Acid Anhydride Definition in Chemistry. Gjenopprettet fra: Thoughtco.com

