Lov om bevaring av materie
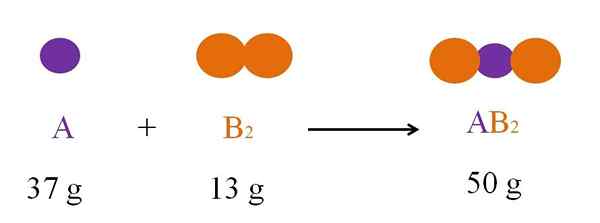
- 3839
- 105
- Prof. Joakim Johansen
Hva er loven om bevaring av materie?
De Lov om bevaring av materie eller masse Det er en som slår fast at i enhver kjemisk reaksjon ikke skapes eller ødelagt materie. Denne loven er basert på det faktum at atomer er udelelige partikler i denne typen reaksjoner; Mens i kjernefysiske reaksjoner er atomene er fragmenterte, og det er derfor de ikke anses som kjemiske reaksjoner.
Hvis atomene ikke blir ødelagt, må antallet atomer være konstant når et element eller forbindelse reagerer, og etter reaksjonen; som oversettes til en konstant mengde masse mellom de involverte reagensene og produktene.
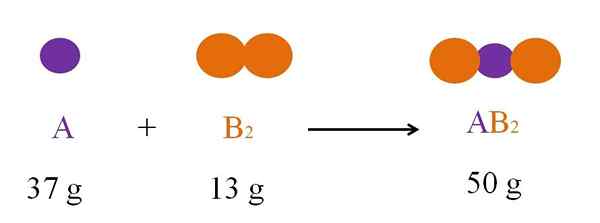 Kjemisk reaksjon mellom A og B2. Kilde: Gabriel Bolívar
Kjemisk reaksjon mellom A og B2. Kilde: Gabriel Bolívar Dette er alltid slik at det ikke er noen lekkasje som forårsaker tap av materie; Men hvis reaktoren er tett lukket, "forsvinner den ikke noe atom, og derfor må den lastede massen være lik massen etter reaksjonen.
Hvis produktet er solid, derimot, vil massen være lik summen av reagensene som er involvert for deres formasjon. Tilsvarende forekommer det med flytende eller gassformige produkter, men det er mer sannsynlig å gjøre feil når du måler de resulterende massene.
Denne loven ble født fra tidligere århundrer eksperimenter, og styrket seg til bidrag fra flere kjente kjemikalier, for eksempel Antoine Lavoisier.
Tenk på reaksjonen mellom A og B2 Å danne ab2 (Øvre bilde). I henhold til loven om bevaring av materie, massen av ab2 Det må være lik summen av massene til a og b2, henholdsvis. Så hvis 37 g a reagerer med 13 g b2, AB -produktet2 Du må veie 50 g.
Derfor, i en kjemisk ligning, reagensmassen (A og B2) må alltid være lik massen av produktene (AB2).
Et eksempel som er veldig likt det nybeskrevne er dannelsen av metalloksider, for eksempel urin eller rust. Rusten er tyngre enn jern (selv om det virker), siden metallet reagerte med en oksygenmasse for å generere oksid.
Hvordan brukes denne loven i en kjemisk ligning?
Massebevaringsloven er av transcendental betydning i støkiometri, sistnevnte blir definert som beregning av kvantitative sammenhenger mellom reagensene og produktene som er til stede i en kjemisk reaksjon.
Prinsippene for støkiometri ble uttalt i 1792 av Jeremiah Benjamín Richter (1762-1807), som definerte den som vitenskapen som måler de kvantitative proporsjoner eller masseforhold til de kjemiske elementene som er involvert i en reaksjon.
I en kjemisk reaksjon er det en modifisering av stoffene som er involvert i den. Det observeres at reagenser eller reaktanter forbrukes for å forårsake produkter.
Kan tjene deg: jernholdige metallerUnder den kjemiske reaksjonen er det bindinger mellom atomer, så vel som dannelsen av nye koblinger; Men antallet atomer som er involvert i reaksjonen forblir uendret. Dette er det som er kjent som loven om bevaring av materie.
Grunnleggende prinsipper
Denne loven innebærer to grunnleggende prinsipper:
-Det totale antallet atomer av hver type er det samme i reagensene (før reaksjonen) og i produktene (etter reaksjonen).
-Den totale summen av de elektriske ladningene før og etter reaksjonen forblir konstant.
Dette er fordi antallet subatomiske partikler forblir konstant. Disse partiklene er nøytroner uten elektrisk ladning, positive belastningsprotoner (+) og negative (-) elektroner (-). Så den elektriske ladningen endres ikke under en reaksjon.
Kjemisk ligning
Når det er sagt ovenfor, når du representerer en kjemisk reaksjon gjennom en ligning (for eksempel hovedbildet), må de grunnleggende prinsippene respekteres. Den kjemiske ligningen bruker symboler eller representasjoner av de forskjellige elementene eller atomene, og hvordan de er gruppert i molekyler før eller etter reaksjonen.
Følgende ligning vil bli brukt igjen som et eksempel:
A+b2 => Ab2
Abonnementet er et nummer som er plassert på riktig del av elementene (B2 og ab2) nederst, som indikerer antall atomer i et element som er til stede i et molekyl. Dette tallet kan ikke endres uten produksjon av et nytt molekyl, forskjellig fra originalen.
Den støkiometriske koeffisienten (1, i tilfelle av A og resten av arten) er et tall som er plassert til venstre for atomer eller molekyler, noe som indikerer antallet deres involvert i en reaksjon.
I en kjemisk ligning, hvis reaksjonen er irreversibel, plasseres en enkelt pil, noe som indikerer betydningen av reaksjonen. Hvis reaksjonen er reversibel, er det to piler i motsatt retning. Til venstre for pilene er reagensene eller reaktantene (A og B2), mens til høyre er produktene (ab2).
Svingende
Balanse En kjemisk ligning er en prosedyre som tillater antall atomer i de kjemiske elementene som er til stede i reagensene med produktene av produktene.
Med andre ord, antallet atomer i hvert element må være det samme på siden av reagensene (før pilen) og på reaksjonsproduktsiden (etter pilen).
Det sies at når en reaksjon er balansert, blir massen av masseaksjonen respektert.
Derfor er det viktig å balansere antall atomer og elektriske ladninger på begge sider av pilen i en kjemisk ligning. På samme måte må summen av massene til reagensene være lik summen av massene av produktene.
Kan tjene deg: Law of Ideal Gases: Formula and Units, Applications, EksemplerI tilfelle av ligningen som er representert, er den allerede balansert (samme antall A og B på begge sider av pilen).
Eksperimenter som demonstrerer loven
Metallforbrenning
Lavoiser, som observerte forbrenning av metaller som bly og tinn i lukkede containere med begrenset luftinntekt, reparerte at metaller ble dekket med en kalsinert; Og i tillegg at vekten av metallet i et bestemt oppvarmingsmoment var lik den første.
Som et metall forbrenne en vektøkning, mente lavoiser at overflødig vekt som ble observert kunne forklares med en viss masse noe som blir trukket ut fra luften under forbrenning. Av denne grunn forble deigen konstant.
Denne konklusjonen, som kan vurderes med et lite solid vitenskapelig grunnlag, er ikke slik, gitt kunnskapen som Lavoiser hadde om eksistensen av oksygen for det øyeblikket han uttalte sin lov (1785).
Oksygenfrigjøring
Oksygen ble oppdaget av Carl Willhelm Scheele i 1772. Deretter oppdaget Joseph Priesley det uavhengig, og publiserte resultatene av forskningen hans, tre år før Scheele publiserte resultatene om den samme gassen.
Priesley varmet kvikksølvmonoksid og plukket opp en gass som ga en økning i flamme glans. I tillegg, ved å introdusere musene i en beholder med gassen, ble de mer aktive. Priesley kalte denne nedsatte gass.
Priesley formidlet observasjonene sine til Antoine Lavoiser (1775), som gjentok eksperimentene hans og demonstrerte at gassen var i luften og i vannet. Lavoiser anerkjente gass som et nytt element, og ga det navnet oksygen.
Da Lavoisier brukte som et argument for å oppgi sin lov, at overflødig masse observert i forbrenning av metaller skyldtes noe som ble trukket ut fra luften, tenkte han på oksygen, et element som er kombinert med metaller under forbrenning.
Eksempler (praktiske øvelser)
Kvikksølvmonoksid dekomponering
Hvis 232.6 av kvikksølvmonoksid (HGO) blir oppvarmet, dekomponerer det i kvikksølv (HG) og molekylært oksygen (eller2). Basert på loven om bevaring av masse- og atomvekter: (Hg = 206,6 g/mol) og (o = 16 g/mol), indikerer massen av Hg og O2 som dannes.
Hgo => hg +o2
232,6 g 206,6 g 32 g
Beregningene er veldig direkte, siden nøyaktig en mol HGO er nedbryter.
Forbrenning av magnesiumbånd
 Burning Magnesium Tape. Kilde: Capt. John Yossarian [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0) eller GFDL (http: // www.gnu.Org/copyleft/fdl.html)], fra Wikimedia Commons
Burning Magnesium Tape. Kilde: Capt. John Yossarian [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0) eller GFDL (http: // www.gnu.Org/copyleft/fdl.html)], fra Wikimedia Commons En 1,2 g magnesiumbånd ble forbrent i en lukket beholder som inneholdt 4 g oksygen. Etter reaksjonen var det 3,2 g oksygen uten å reagere. Hvor mye magnesiumoksyd ble dannet?
Det kan tjene deg: Statusendringer: Typer og deres egenskaper (med eksempler)Den første tingen å beregne er oksygenmassen som reagerte. Dette kan enkelt beregnes ved subtraksjon:
Masse av o2 som reagerte = innledende masse på eller2 - Endelig masse av o2
(4 - 3,2) g eller2
0,8 g O2
Basert på loven om massekonservering, kan du beregne massen av MgO dannet.
MgO masse = mg masse + masse av o
1,2 g+0,8 g
2,0 g MgO
Kalsiumhydroksid
En masse på 14 g kalsiumoksyd (CaO) reagerte med 3,6 g vann (h2O), som ble fullstendig konsumert i reaksjonen på form 14,8 g kalsiumhydroksid, CA (OH)2:
Hvilken mengde kalsiumoksyd reagerte for å danne kalsiumhydroksid?
Hvilken mengde kalsiumoksid var over?
Reaksjonen kan skjematiseres etter følgende ligning:
Cao + H2O => ca (å)2
Ligningen er balansert. Oppfyller derfor massekonserveringsloven.
Cao -masse involvert i reaksjonen = massen av Ca (OH)2 - masse h2ENTEN
14,8 g - 3,6 g
11.2 g Cao
Derfor beregnes CAO som ikke reagerte (den som er igjen) ved å lage en subtraksjon:
Superant Cao -masse = masse til stede i reaksjonen - Masse som grep inn i reaksjonen.
14 g Cao - 11,2 g Cao
2,8 g Cao
Kobberoksid
Hvor mye kobberoksid (Cuo) vil bli dannet når 11 g kobber (Cu) med oksygen (eller2)? Hvor mye oksygen er nødvendig i reaksjonen?
Det første trinnet er å balansere ligningen. Den balanserte ligningen er som følger:
2CU + O2 => 2cuo
Ligningen er balansert, så den er i samsvar med loven om massebevaring.
Atomvekten til Cu er 63,5 g/mol, og co -molekylvekten er 79,5 g/mol.
Du må bestemme hvor mye COO som dannes fra fullstendig oksidasjon av 11 g Cu:
Cuo masse = (11 g Cu) ∙ (1 mol Cu/63,5 g Cu) ∙ (2 mol CuO/2mol Cu) ∙ (79,5 g Cuo/mol Cuo)
CUO -massedannet = 13,77 g
Derfor gir forskjellen i massene mellom CUO og Cu mengden oksygen involvert i reaksjonen:
Oksygenmasse = 13,77 g - 11 g
1,77 g o2
Natriumkloriddannelse
En masse klor (CL2) på 2,47 g ble reagert med tilstrekkelig natrium (Na) og 3,82 g natriumklorid (NaCl) ble dannet. Hvor mye na reagerte?
Balansert ligning:
2na + Cl2 => 2nacl
I henhold til massekonserveringsloven:
Na = NaCl -masse - CL -masse2
3,82 g - 2,47 g
1,35 g Na
Referanser
- National Polytechnic Institute. (s.F.). Lov om bevaring av masse. CGFIE. Gjenopprettet fra: aev.CGFIE.IPN.MX
- Lov om bevaring av masse. Gjenopprettet fra: Thoughtco.com

