Arsen historie, struktur, egenskaper, bruker

- 4570
- 868
- Jonathan Carlsen
Han arsenikk Det er en semimetal eller metalloid som tilhører gruppe 15 eller går fra det periodiske bordet. Det er representert av det kjemiske symbolet som, og har atomnummeret 33. Det kan være under tre allotropiske former: gul, svart og grå; Sistnevnte er den eneste med industriell betydning.
Gray Arsen er et metallisk, skjørt -seende faststoff, med en steely og krystallinsk farge (nedre bilde). Mister lysstyrken når den blir utsatt for luftdannende arseniosoksid (som som2ENTEN3), som når oppvarmet avgir en lukt av hvitløk. På den annen side er dens gule og svarte alotrochos henholdsvis molekylære og amorfe.
 Metallisk arsen. Kilde: Hi-res Images ofchemical Elements [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]
Metallisk arsen. Kilde: Hi-res Images ofchemical Elements [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)] Arsen ligger i jordskorpen assosiert med mange mineraler. Bare en liten andel er i en innfødt tilstand, men assosiert med antimon og sølv.
Blant de vanligste mineralene som arsen er følgende, er: Rejalgar (som som4S4), orpimentet (som som2S3), Loellingita (stygg2) og Enargita (Cu3Ass4). Arsen oppnås også som et sikkerhetsprodukt av støperiet av metaller som bly, kobber, kobolt og gull.
Arsenforbindelser er giftige, spesielt Arsina (aske3). Arsen har imidlertid mange industrielle applikasjoner, inkludert legering med bly, brukt i utdyping av bilbatterier, og legeringen med gallium med flere bruksområder i elektronikk.
[TOC]
Historien om oppdagelsen din
Navnet 'arsen' kommer fra det latinske arsenicum og den greske arsenikon, og refererer til gul oropiment, som utgjorde hovedformen for bruk av arsen av alkymister.
Arsen lenge før det ble gjenkjent som et kjemisk element, ble kjent og brukt i form av dets forbindelser. For eksempel Aristoteles i det fjerde århundre.C. Han skrev om Sandarache, et stoff som nå antas at det var arsen sulfid.
Plinio El Viejo og Pivanio Discorides, på 1. århundre.C., De beskrev orpimentet, et mineral som består av2S3. I det ellevte århundre ble tre arsenarter gjenkjent: hvitt (som som4ENTEN4), Den gule (som som2S3) og rødt (som4S4).
Arsen som et rent element ble observert for første gang av Albertus Magnus (1250). Magnus oppvarmet arsen sulfid med såpe, mer. Imidlertid ble den første autentiske rapporten om isolasjonen publisert i 1649 av Johann Schroeder, en tysk farmasøyt.
Schroeder tilberedte arsen ved å varme opp kulloksydet. Deretter klarte Nicolas Lémery å varme den opp ved å varme opp en blanding av arsenoksid, såpe og potash. På 1700 -tallet ble dette elementet endelig anerkjent som en semimetal.
Det kan tjene deg: Ingen elektrolytter: Kjennetegn og eksemplerArsen struktur
Arsen er isomorf for antimon; Dette er strukturelt de er identiske, bare forskjellige i størrelsen på atomene sine. Hvert atom av arsen danner tre som kovalente bindinger, på en slik måte at de også stammer fra sekskantede enheter6 "Rynket eller bratt", siden hybridiseringen av AS -atomer er SP3.
Så enhetene6 De kobler seg til bratte arsenlag, som samhandler svakt med hverandre. Etter deres intermolekylære krefter, hovedsakelig avhengig av atommassene deres, gir de grå arsen rhomneniske krystaller det faste stoffet en skjør og sprø tekstur.
Muligens på grunn av frastøttene til de arseniske elektronene, enhetene6 Dannet mellom parallelle lag definerer ikke en perfekt oktaedron, men forvrengt:
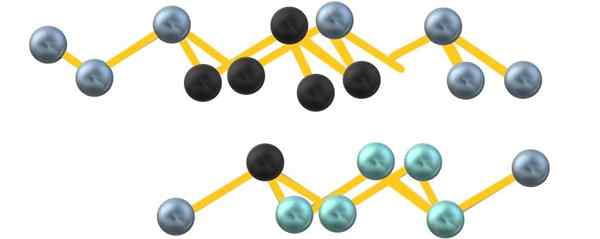 Grå arsen krystallinsk struktur. Kilde: Gabriel Bolívar.
Grå arsen krystallinsk struktur. Kilde: Gabriel Bolívar. Merk at de svarte kulene trekker det forvrengte planet i rommet mellom to bratte lag. I laget nedenfor er det også blålige kuler som ved siden av den svarte sfæren utgjør enheten6 nevnt i begynnelsen av seksjonen.
Strukturen ser bestilt ut, radene stiger og går ned, og er derfor krystallinsk. Imidlertid kan du bli amorf, med klemmede sfærer på forskjellige måter. Når gråaktig arsen blir amorf, blir det en halvleder.
Gul arsen
Den gule arsen, den mest giftige alotropiske av dette elementet, er et bare molekylært faststoff. Består av som molekyler4 enheter ved svake spredningskrefter, som ikke forhindrer dem i å flyktige.
Svart arsen
Svart arsen er amorf; Men ikke hvordan kan den gråaktig alotrope være. Strukturen er litt lik den nylige6 De har større områder og forskjellige lidelsesmønstre.
Elektronisk konfigurasjon
[AR] 3D104s24p3
Har alle orbitaler på nivå 3 fulle. Formkoblinger ved bruk av 4S og 4P orbitaler (samt 4D) av forskjellige kjemiske hybridiseringer.
Egenskaper
Molekylær vekt
74.922 g/mol
Fysisk beskrivelse
Gray Arsen er et gråaktig metallisk utseende solid og sprø konsistens.
Farge
Tre allotropiske former, gul (alfa), svart (beta) og grå (gamma).
Lukt
Toalett
Smak
Smakløs
Smeltepunkt
1.090 K på 35,8 atm (Triple Arsenic Point).
Ved normalt trykk har ikke noe fusjonspunkt, siden det sublimerer 887 K.
Tetthet
-Grå arsen: 5,73 g/cm3.
Det kan tjene deg: karbonylgruppe: egenskaper, egenskaper, nomenklatur, reaktivitet-Gul arsen: 1,97 g/cm3.
Vannløselighet
Uoppløselig
Atomisk radio
139
Atomisk volum
13,1 cm3/mol
Radiokovalent
120 pm
Spesifikk varme
0,328 J/g · mol ved 20 ºC
Fordampningsvarme
32,4 kJ/mol
Elektronegativitet
2,18 på Pauling -skalaen
Ioniseringsenergi
Første ioniseringsenergi 946,2 kJ/mol
Oksidasjonsstater
-3, +3, +5
Stabilitet
Elementær arsen er stabil i tørr luft, men når den blir utsatt for den fuktige luften, er den dekket med et gulbronselag som kan bli et svart lag med arsenoksid (2ENTEN3).
Nedbrytning
Når arsen blir oppvarmet til nedbrytning, avgir den en hvit røyk fra AS2ENTEN3. Prosedyren er farlig fordi Arsina også kan sendes ut, en veldig giftig gass.
Selvretning
180 ºC
Hardhet
3.5 On Mohs Hardness Scale.
Reaktivitet
Det blir ikke angrepet av kald svovelsyre eller konsentrert saltsyre. Reagerer med salpetersyre eller varm svovelsyre, danner arsenesyre og arseninsyre.
Når grå arsen er flyktig ved oppvarming, og damper raskt avkjøles, dannes en gul arsen. Dette går tilbake til den gråaktige formen, når den blir utsatt for ultrafiolett lys.
applikasjoner
Legeringer
En liten mengde arsen lagt til for å bly, herder legeringene nok til å bruke dem i slimhinnen på kablene, og i utdypingen av bilbatterier.
Tilsetning av arsen til messingen, en legering av kobber og sink, øker dens motstand mot korrosjon. På den annen side korrigerer eller reduserer tapet av sink i messingen, noe som forårsaker en økning i dens levetid.
Elektronikk
Renset arsen brukes i halvledeteknologi der den brukes i forbindelse med gallisk.
GAA -ene har et direkte båndintervall, som kan brukes i fremstilling av dioder, laser og LED. I tillegg til Gallium Arseniuro er det andre Arseniuros, som indiske Arseniuro og aluminium Arseniuro, som også utgjør II-V-halvledere.
I mellomtiden er Cadmium Arseniuro en halvleder av Type II-IV. Arsina har blitt brukt i halvlederdoping.
Landbruk og bevaring av tre
De fleste bruksområder har blitt kastet på grunn av deres store toksisitet og forbindelsene deres. AS2ENTEN3 har blitt brukt som plantevernmiddel, mens esset2ENTEN5 Det er en ingrediens i ugressmidler og insektmidler.
Arseninsyre (h3Aso4) og salter som kalsium og blyarsenat, har blitt brukt til å sterilisere jordsmonn og kontrollere skadedyr. Dette genererer en risiko for miljøforurensning med arsen.
Kan tjene deg: flytende elementer: hva er og eksemplerBly Arseniato ble brukt som et insektmiddel i frukttrær, frem til første halvdel av det tjuende århundre. Men på grunn av dens toksisitet ble det erstattet av natriummetylarsenat, som sluttet å bli brukt av samme grunn siden 2013.
Medisin
Inntil det tjuende århundre ble flere av forbindelsene deres brukt som medisiner. Arsfenamina og Neolsalvarsan ble for eksempel brukt i behandlingen av syfilis og triposomiasis.
I 2000 ble bruken av AS godkjent2ENTEN3, Veldig giftig forbindelse, i behandlingen av akutt promineo-resistent lovende å retino-trans syresyre. Nylig ble den radioaktive isotopen brukt 74Når det gjelder plasseringen av svulster.
Isotopen produserer gode bilder, tydeligere enn de som er oppnådd med 124Jeg, fordi jod blir ført til skjoldbruskkjertelen og produserer støy i signalet.
Andre bruksområder
Arsen ble brukt i fortiden som en additiv fôr i produksjonen av fjærkre og griser.
Det brukes som en katalysator i produksjon av etylenoksyd. Det brukes også i pyroteknikk og brunfarge. Arsenioso -oksid brukes som en avfarge i glassproduksjon.
Hvor befinner det seg?
Arsen finner du i små mengder i en elementær tilstand, med høy grad av renhet. Det er til stede i mange forbindelser, for eksempel: sulfider, arsenuros og sulfareniuros.
Det finnes også i flere mineraler, inkludert: Arsenopyrite (Fesas), Loellingita (stygg2), Enargita (Cu3Ass4), orpimentet (som som2S3) Og Rejalgar (som4S4).
Hvordan oppnås det?
Arsenopirita varmes opp til 650-700 ºC, i fravær av luft. Arsen fordamper, og etterlater jernsulfid (FES) som rest. Under denne prosessen binder arsen seg til oksygen for å danne4ENTEN6, kjent som "White Arsen".
AS4ENTEN6 Det er modifisert for å danne AS2ENTEN3, hvis damper blir samlet og kondensert i et sett med mursteinkameraer, rensende arsen ved sublimering.
Det meste av arsen produseres ved å redusere karbonet i støvet som er dannet fra2ENTEN3.
Referanser
- Stephen r. Marsden. (23. april 2019). Kjemi av arsen. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (3. desember 2018). Interessante fakta om arsen. Gjenopprettet fra: Thoughtco.com
- Wikipedia. (2019). Arsenikk. Hentet fra: i.Wikipedia.org
- Dr. Deig Stewart. (2019). Arsen elementfakta. Chemicool. Gjenopprettet fra: Chemicool.com
- Royal Society of Chemistry. (2019). Arsenikk. Gjenopprettet fra: RSC.Eller
- Redaktørene av Enyclopaedia Britannica. (3. mai 2019). Arsenikk. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- « Kjennetegn minoritetsgrupper, typer, eksempler
- Reynolds nummer Hva er det for, hvordan det beregnes, øvelser »

