Berkelio (BK) struktur, egenskaper, innhenting, bruk

- 2544
- 196
- Theodor Anders Hopland
Han Berkelium Det er et kjemisk element hvis symbol er BK. Det tilhører klassen av aktinider, som det åttende medlemmet. Atomnummeret ditt er 97. Det er et syntetisk metallisk fast stoff. Dette elementet finnes ikke naturlig over jordskorpen. Det er til stede i små mengder i brukt kjernefysisk drivstoff og har sølvglans.
Det er også små mengder spredt i miljøet på grunn av testene av atomvåpen, på grunn av alvorlige ulykker i atomenergianlegg som Tsjernobyl og ved frigjøringen som oppstår fra avfall fra atomenergianlegg.
 Symbol, antall og atommasse av Berkelio -elementet. Kilde: ME/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/2.5). Kilde: Wikimedia Commons.
Symbol, antall og atommasse av Berkelio -elementet. Kilde: ME/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/2.5). Kilde: Wikimedia Commons. Et praktisk verktøy for Berkelio er ikke funnet, fordi det forekommer i veldig små mengder og det faktum at alle dens isotoper (BK -atomer med forskjellige antall nøytroner i kjernen) er radioaktive. Den viktigste anvendelsen har vært i vitenskapelige studier.
Selv om isotoper er kunstig produsert i spesielle laboratorier og håndteres av ekspertpersonell, bør skadene som den farlige strålingen alltid tas i betraktning.
[TOC]
Nomenklatur
- Berkelio, BK -symbol.
- Berkelio-243, BK-243 eller 243BK: Berkelio Isotope med atommasse 243.
Oppdagelse
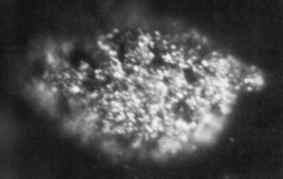 1,7 mikrofotografi Mikrogram av fast metallisk Berkelio oppnådd i 1969. Oak Ridge National Laboratory, US Department of Energy / Public Domain. Kilde: Wikimedia Commons.
1,7 mikrofotografi Mikrogram av fast metallisk Berkelio oppnådd i 1969. Oak Ridge National Laboratory, US Department of Energy / Public Domain. Kilde: Wikimedia Commons. Det ble først produsert i 1949 av forskerne Glen Seaborg, Stanley G. Thompson og Al Ghiorso ved Berkeley University i California, da de bombarderte Americio-241 med alfa-partikler med høy energi ved bruk av en syklotron (en partikkelakselerator).
Umiddelbart etter bestråling ble materialet riktig oppløst og ført gjennom en ionebytteharpiks -kolonne ved bruk av en ammoniumsitratoppløsning som eluering.
På denne måten oppnådde de en isotop av elementnummer 97 med 243 atommasse, som avgir alfapartikler og har en halvliv på 4,5 timer.
Elementnavn
Til å begynne med foreslo flere forskere at elementet tar navnet på en av oppdagerne, Glen Seaborg, siden han hadde fortjenesten av å ha klart å syntetisere 10 elementer i flere års arbeid.
Kan tjene deg: BeakerImidlertid den offisielle organisasjonen International Union of Pure and Applied Chemistry eller IUPAC (forkortelse for engelsk International Union of Pure and Applied Chemistry) bestemte seg for å tildele navnet "Berkelio" for å ha blitt oppnådd ved universitetet og byen Berkeley (California).
 Utseende av et område ved University of Berkeley, Califronia. Forfatter: Sarangib. Kilde: Pixabay.
Utseende av et område ved University of Berkeley, Califronia. Forfatter: Sarangib. Kilde: Pixabay. Navnet Berkeley kommer fra Angloirlandés -filosofen George Barkeley, et navn hvis uttale deretter endret seg i USA da byen og universitetet ble grunnlagt i 1869.
Det var tilfeldig året som Dmitri Mendeléyev publiserte sitt første periodiske bord og begynte å forutsi eksistensen av nye elementer som Berkelio.
Elektronisk struktur
Den elektroniske konfigurasjonen er:
1s2; 2s2 2p6; 3s2 3p6 3d10; 4s2 4p6 4d10 4F14; 5s2 5p6 5d10; 6s2 6p6; 5F9 7s2,
eller kompakt:
[RN] 5F9 7s2.
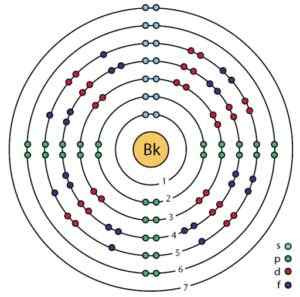 Berkelio elektronisk struktur. Orbitaler og elektroner kan sees. Ahazard.ScienceWriter/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons.
Berkelio elektronisk struktur. Orbitaler og elektroner kan sees. Ahazard.ScienceWriter/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons. Å skaffe
Den første prøven av metallet ble fremstilt i 1969 gjennom en fluorreduksjonsreaksjon (BKF3) Med litiummetall (Li) ved en temperatur på 1300 K.
For å tilberede tynne metallark reduseres BKO -oksid2 Med Torio (TH) eller metallisk Lantano.
Berkelios fysiske egenskaper
Fysisk tilstand
Sille metallisk faststoff.
Berkelio -metallet har to krystallinske former: alfa (dobbel kompakt sekskant) og beta (kubikk sentrert på ansikter).
Atommasse
247
Smeltepunkt
1050 ºC (alfaform)
986 ° C (betaform)
Kokepunkt
2627 ºC
Tetthet
14,78 g/cm3 (alfa form)
13,25 g/cm3 (beta -skjema)
Paramagnetisme
I følge noen kilder viser visse Berkelio -forbindelser paramagnetiske egenskaper, noe som betyr at de er tiltrukket av magnetiske felt.
Denne egenskapen er av paramagnetisk type fordi når det suspenderer magnetisk handling ikke klarer å opprettholde slike egenskaper alene.
Kjemiske egenskaper
Ved høye temperaturer oksideres den metalliske Berkelio raskt i luft eller oksygen, og danner oksydene. Det er lett løselig i mineralsyrer, og frigjør hydrogengass H2 og danner BK -ioner3+.
Kan tjene deg: aluminiumhydrid (ALH3): struktur, egenskaper, brukOksidasjonsstater
De første undersøkelsene av dette elementet var begrenset til ionebytte- og koprekipitasjonseksperimenter, som det ble observert at oksidasjonstilstanden +3 er stabil og +4 er tilgjengelig i vandig løsning, siden BK3+ Det kan oksideres av bromationen (bro4-) Å gi BK4+.
BK -stabilisering4+
I 2017 ble stabiliseringen av BK rapportert4+ I løsning ved bruk av forbindelsen dannet av hydroksipiridinongrupper forent til en polyaminstruktur (kalt ligand 3,4,3-Li (1,2-hop))).
Denne forbindelsen har åtte steder der ionet blir sammen med, som tilsvarer oksygenatomene i gruppene C = O og N-OH, og etterlater BK4+ fast knyttet til ligand, forblir stabil.
Faste forbindelser
BK4+ kan kopipitere med Cerio (CE4+) eller zirkonium (ZR4+) i fosfat eller yodato. Det kan også trekkes ut i bis heksanløsninger (2-etylhexil) hydrogenofosfat eller annet lignende imøtekommende middel.
Den første Berkelio -forbindelsen som skjedde i synlige mengder var klorid (BKCL3), hvorav 0,000000003 gram ble oppnådd i 1962. Siden den gang har flere Berkelio -forbindelser vært i stand til å tilberede og studere.
De kan nevnes for eksempel fosfat (BKPO4), Oxychloride (BKOCL), Fluorides (BKF3 og BKF4), Dioksid (BKO2), trioksid (BK2ENTEN3), Yodatos (BK (IO3)3 og BK (io3)4), Klorhydrat [bkcl2(H2ENTEN)6] CL, oksalat, organethaliske forbindelser og koordinasjonsforbindelser, blant andre.
Ny oksidasjonstilstand +5
I 2018 klarte en gruppe etterforskere fra flere land å produsere et nitratkompleks med Pentavalent Berkelio (BK5+) hvis formel er bko2(NEI3)2-, Ved å eliminere to ingen molekyler2 av BK -ionet (nei3)4-, (Bk3+).
Beregningsenergiberegninger bekreftet at oksidasjonstilstanden +5 er den som har den største stabiliteten i dette Berkenilo -nitratkomplekset, derfor mest sannsynlig.
Isotoper
Fra Berkelio er 14 isotoper med atommasser blitt syntetisert fra 238 til 251. Alle er radioaktive.
Det kan tjene deg: Benchilo: Benzylhydrogener, karbokasjoner, benzylradikalerDen mest stabile er Berkelio-247, hvis halveringstid er 1380 år. Hvert atom av denne isotopen når oppløsning avgir en alfapartikkel og danner et Atom of America-243.
BK-249 har en halveringstid på 330 dager, lider beta-forfall og blir Californio-249.
applikasjoner
Siden de bare har vært i stand til å oppnå veldig små mengder av dette elementet, har det bare bruk i grunnleggende vitenskapelig forskning.
Ved å få tyngre elementer
Isotopen BK-249 har relativt lang halveringstid og det er mulig.
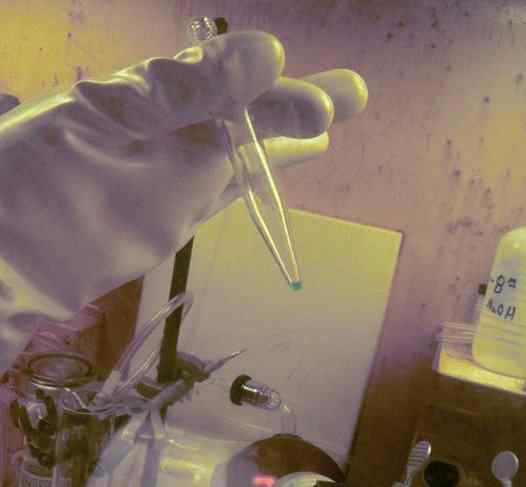 BK -mikrocantitet oppløst i et testrør. 250 dager ble brukt for å få den. Radioaktivitetsbeskyttelseshanske for dette elementet kan observeres. Ornl, Department of Energy / Public Domain. Kilde: Wikimedia Commons.
BK -mikrocantitet oppløst i et testrør. 250 dager ble brukt for å få den. Radioaktivitetsbeskyttelseshanske for dette elementet kan observeres. Ornl, Department of Energy / Public Domain. Kilde: Wikimedia Commons. I fysisk -kjemiske studier
Forskningen utført med BK tillater mer presise ekstrapolasjoner om egenskapene og atferden til andre elementer som følger i skuespillerserien, ettersom de tyngste elementene er vanskeligere å få tak i, de har veldig korte gjennomsnittlige liv og er mye mer radioaktive.
Risiko
Berkelio er et radioaktivt element. Radioaktivitetsfrigjøring i miljøet kan nå alle arter av dyr og planter som forårsaker skade på dem. Forverring kan samle seg i påfølgende generasjoner.
 Nuclear Energy -anlegg er radioaktive og derfor veldig farlige. Forfatter: AR130405. Kilde: Pixabay.
Nuclear Energy -anlegg er radioaktive og derfor veldig farlige. Forfatter: AR130405. Kilde: Pixabay. Referanser
- ELLER.S. National Library of Medicine. (2019). Berkelium - BK (element). Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Hvit, f.D. et al. (2019). Samtidig kjemi av Berkelium og Californium. Kjemi 2019 6. august; 25 (44): 10251-10261. Gjenopprettet fra PubMed.NCBI.NLM.NIH.Gov.
- Bly, d.R. (Editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Kelley, m.P. et al. (2018). Bindingskobecy og oksidasjonstilstand av aktinid-INS komplekset med terapeutisk chelateringsmiddel 3,4,3-Li (1,2-hopo). Inorg. Chem. 2018 7. mai; 57 (9): 5352-5363. Gjenopprettet fra PubMed.NCBI.NLM.NIH.Gov.
- Kovács, a. et al. (2018). Pentavalent curium, Berkelium og Californium i nitratkompleks: Utvidelse av aktinidkjemi og oksidasjonstilstander. Chem. 2018 6. august; 57 (15): 9453-9467. Gjenopprettet fra PubMed.NCBI.NLM.NIH.Gov.
- Orlova, a.Yo. (2007). Kjemi og strukturell kjemi av vannfri tri-totravalent aktinid ortofosfere. I strukturell kjemi av uorganiske aktinidforbindelser. Gjenopprettet fra Scientedirect.com.
- Choppin, g. et al. (2013). Aktinid- og transaktinidelementene. I RadioChemistry and Nuclear Chemistry (fjerde utgave). Gjenopprettet fra Scientedirect.com.
- Peterson, J.R. og Hobart, D.OG. (1984). Kjemien til Berkelium. Fremskritt uorganisk kjemi, bind 28, 1984, side 29-72. Gjenopprettet fra Scientedirect.com.
- Royal Society of Chemistry. (2020). Berkelium. RSC kom seg.org.

