Beta galaktosidaseegenskaper, struktur, funksjoner
- 1780
- 240
- Prof. Joakim Johansen
De Beta galaktosidase, Også kalt ß-galaktosidase eller β-D-galakthydrolyse er et enzym som tilhører familien av glykosilhydrolaser som er i stand til å hydrolysere galaktosylavfall av forskjellige typer molekyler: polymerer, oligosakarider og sekundære metabolitter, blant andre: polymerer, oligosakarider og sekundære metabolitter, blant andre:.
Tidligere kjent som "laktase", er dens distribusjon, så vel som for oligo- og ß-galaktositetspolysakkarider som fungerer som underlag, ekstremt bredt. Det finnes i bakterier, sopp og gjær; I planter er det vanlig i mandler, fersken, aprikos og epler, og hos dyr er det til stede i organer som mage og tarm.
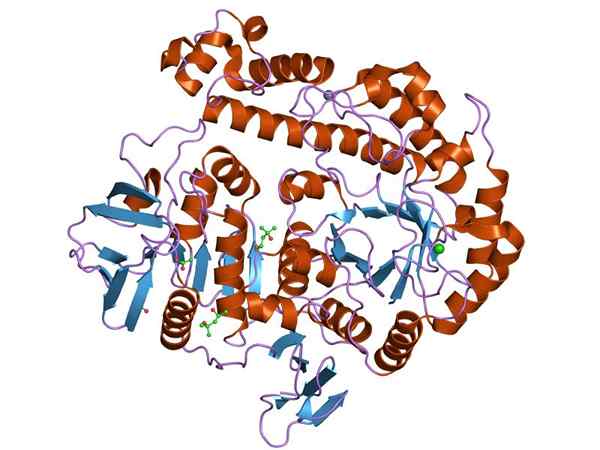
 Grafisk representasjon av strukturen til B-Galactosidase-enzymet (Kilde: Jawahar Swaminathan og MSD-ansatte ved European Bioinformatics Institute [Public Domain] via Wikimedia Commons)
Grafisk representasjon av strukturen til B-Galactosidase-enzymet (Kilde: Jawahar Swaminathan og MSD-ansatte ved European Bioinformatics Institute [Public Domain] via Wikimedia Commons) Det mest studerte enzymet er opeon Lac av OG. coli, Gen kodet Lacz, hvis studier har vært nøkkelen til å forstå funksjonen til genetiske operater og mange regulatoriske aspekter av dem.
Det tilhører for tiden den best -studerte enzymgruppen, og deres mest kjente funksjon er hydrolysen av glukosidiske koblinger av laktose. Den oppfyller viktige metabolske funksjoner i organismer som uttrykker det og brukes også med forskjellige industrielle formål.
Blant industrielle anvendelser er fjerning av laktose av meieriprodukter for laktoseintolerante mennesker og produksjon av flere galaktositetsforbindelser. De brukes også til å forbedre sødmen, smaken og fordøyelsen av mange meieriprodukter.
[TOC]
Kjennetegn
I tillegg til galaktositetssubstrater som laktose, krever de fleste av kjente ß-galaktosidaser divalente metallioner som magnesium og natrium. Dette har blitt bevist med oppdagelsen av unionssteder for disse metaller i strukturen.
Β-galaktosidas til stede i naturen har et stort utvalg av pH-områder som de kan jobbe. Soppenzymer fungerer i syremiljøer (2.5 til 5.4), mens gjær og bakterier fungerer mellom 6 og 7 pH -enheter.
Kan tjene deg: gram negative bakterierβ-galaktosidas bakterie
Bakterier har store galato-hydrolytiske enzymer sammenlignet med andre galaktosidas analysert. I disse organismer katalyserer det samme enzymet tre typer enzymatiske reaksjoner:
- Hydrolyza laktose til sine konstitutive monosakkarider: galaktose og glukose.
- Katalyserer transgastilering av laktose til alolaktosen, et disakkaridsukker som deltar i den positive reguleringen av uttrykket av genene som tilhører opeone Lac, Eç.
- Hydrolyserer alolaktosen som ligner på hvordan den gjør med laktose.
β-galaktosidas sopp
Sopp har ß-galaktosidase-enzymer som er mer utsatt for galaktoseinhibering enn enzymer som tilhører andre organismer. Imidlertid er disse termostabile og fungerer i sur pH -områder.
Laktosemetabolisme mediert av disse enzymene i sopp er delt inn i ekstracellulær og cytosolisk.
Struktur
Det ß-galaktosidase-enzymet av bakterier er et tetramerisk enzym (av fire identiske underenheter, A-D), og hver av dens monomerer har mer enn 1.000 aminosyreavfall, som betyr en molekylvekt på mer enn 100 kDa for hver og mer enn 400 kDa for det komplekse proteinet.
Hos planter er tvert imot enzymet betydelig mindre størrelse og kan ofte finnes som en dimer av identiske underenheter.
Domenene til hver monomer skilles ut med tallene fra 1 til 5. Domene 3 har en tønne struktur α/β “Tim” og har det aktive stedet i den C-terminale enden av tønnen.
Kan tjene deg: dyre- og planteorganogenese og dens egenskaperDet antas at de aktive stedene i det enzymatiske komplekset deles mellom monomerer, så dette enzymet er biologisk aktivt bare når det er kompleks som en tetrameter.
Det aktive stedet har muligheten til å bli med i D-glukosa og D-galaktose, de to monosakkaridene som utgjør laktose. Det er spesielt spesifikt for D-galaktosen, men det er ikke så mye for glukose, så enzymet kan virke på andre galaktosider.
Funksjoner
Hos dyr
I tarmen av mennesker har hovedfunksjonen til dette enzymet å gjøre med absorpsjonen av laktose inntatt med mat, da det ligger på luminal ansiktet til plasmamembranen til tarmceller i form av en børsteform.
I tillegg er det vist at de lysosomale isoformene av dette enzymet deltar i nedbrytningen av mange glukolipider, mucopolysakkarider og galaktositetsglykoproteiner, som har flere formål på forskjellige cellulære ruter.
I planter
Planter har ß-galaktosidase-enzymer på blader og frø. Disse oppfyller viktige funksjoner i katabolismen til galaktolipidene, som er karakteristiske for alger og planter generelt.
I disse organismer deltar ß-galaktosidase i prosessene med plantevekst, modning av frukt og i de øvre plantene er dette det eneste kjente enzymet som er i stand til å hydrolysere galaktosylavfall fra galakositetspolysakkaridene i celleveggen.
Innen industri og forskning
I matindustrien relatert til meieriprodukter brukes ß-galaktosidase-enzymet til å katalysere hydrolysen av laktose som er til stede i meieriprodukter, som er ansvarlig for mange av feilene relatert til lagring av disse produktene.
Hydrolysen av dette sukkeret søker å unngå sedimentasjon av partikler, krystallisering av frosne meierimiljøer og tilstedeværelsen av "sand" -teksturer i de fleste kommersielle derivater av melk.
Kan tjene deg: Jordens næringskjede: lenker og eksempelDen ß-galaktosidase som brukes industrielt oppnås ofte fra soppen Aspergillus sp., Selv om enzymet produsert av gjær Kluyveromyces Lactis Det er også mye brukt.
Β-galaktosidaseaktiviteten, som oversettes til vitenskapelige termer som "laktosegjæring", blir rutinemessig testet for identifisering av gramnegative enterobakterier som er til stede i forskjellige typer prøver.
I tillegg brukes det i medisinske termer for produksjon av laktosefrie meieri og for formulering av tabletter som brukes av laktoseintolerante mennesker for å fordøye melk og deres derivater (yoghurt, ost, is, smør, kremer osv.).
Det brukes som "biosensorer" eller "biomarkør" med mangfold av formål, fra immunoanalyser og toksikologisk analyse til analyse av genuttrykk og diagnose av patologier takket være den kjemiske immobiliseringen av dette enzymet i spesielle støtte i spesielle støtte.
Referanser
- Henrissat, f., & Daviest, G. (1997). Strukturell og sekvensbasert klassifisering av glykosidhydrolas. Nåværende biologi, 7, 637-644.
- Huber, r. (2001). Beta (b) -galactosidase. Akademisk presse, 212-214.
- Husain, q. (2010). β Galactosidaese og deres potensielle applikasjoner: En gjennomgang. Kritiske gjennomganger i bioteknologi, 30, 41-62.
- Dommer, d. H., Matthews, f. W., & Huber, r. OG. (2012). Lacz b-galaktosidase: struktur og funksjon av et enzym av historisk og molekylær biologisk betydning. Vitenskapsprotein, tjueen, 1792-1807.
- Lee, f. OG., Han, J. TIL., Im, J. S., Morrone, a., Johung, k., Goodwin, c.,... Hwang, og. S. (2006). Senescence -Asociated β -galaktosidase er lysosomal β -gastosidase. Aldrende celle, 5, 187-195.
- Matthews, f. W. (2005). Strukturen til e. β-galaktosidase coli. C. R. Biologier, 328, 549-556.
- McCarter, J. D., & Withers, S. G. (1994). Mekanismer for enzymatisk glykosidhydrolyse. Nåværende mening i strukturell biologi, 4, 885-892.
- Richmond, m., Gray, J., & Stine, C. (1981). Beta-Galactosidase: Gjennomgang av nyere. J Dairy Sci, 64, 1759-1771.
- Wallenfels, k., & Weil, r. (1972). B-galaktosidase.

