Borakshistorie, struktur, egenskaper, bruksområder, syntese, risikoer

- 1878
- 265
- Marius Aasen
Han Boraks eller natriumborat Det er et kirkesamfunn for en gruppe kjemiske forbindelser med en baseformel av NA2B4ENTEN7. Det er et hygroskopisk salt som er i stand til å danne mange hydrater, i tillegg til å strukturelt berike seg selv ved tilstedeværelse av visse metallforurensninger.
Hovedforbindelsene som kalles Borax er følgende: Anhydro natrium tetorat, Na2B4ENTEN7; Pentahydrat natrium tetretorat (na2B4ENTEN7).5H2ENTEN; og natrium tetabrorat, na2B4ENTEN7.10H2Eller, eller tilsvarende, oktahydrat natrium tetorat, na2B4ENTEN5(ÅH)4.8H2ENTEN.
 Boraksfragment. Kilde: Leon Hupperichs [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Boraksfragment. Kilde: Leon Hupperichs [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Som det kan sees, er alle tidligere faste stoffer bare forskjellige i graden av hydrering; Noen har flere vannmolekyler i krystaller enn andre. Fysisk boraks ligner stykker eller robuste krittkrystaller (overlegen bilde).
Naturligvis finnes boraks i sedimenter av sesongens innsjøer, tørket ved fordampning. Boraks forekommer i Tyrkia, Searles Lakes (California), i Atacama, Chile, Bolivia, Tibet og Romania Desert. Syntetisk kan borakskrystaller oppnås gjennom en langsom kjerneprosess; det vil si en hvor veksten av krystallene er foretrukket.
Natrium, vannfri og forfallydrert tetabrorat er lite oppløselig i kaldt vann; Men løseligheten øker med en temperaturøkning. Deretter en2B4ENTEN7.10H2Eller det er veldig løselig i etylenglykol, moderat oppløselig i etanol og lite oppløselig i aceton; Dette er mindre polare løsningsmidler enn vann.
Borax har mange applikasjoner, for eksempel i utdyping av vaskemidler og såper; som en forsinkelse av brannen til cellulosematerialet; i glassfiberproduksjon; i rengjøring av harde overflater som metaller, glass og keramikk; og i korrosjonshemming, blant annet bruk.
Borax er irriterende for øyne, hud og luftveier. Ved svelging kan det blant annet gi symptomer, oppkast, diaré, slapp, forfall og anfall. Det er foreløpig mistenkt at skadelige effekter på menneskelig reproduksjon kan ha.
[TOC]
Historie
Boraksens historie er forvirrende. Det påpekes at det ble oppdaget i sengen til en Tibet -innsjø, tørket ved fordampning. Den ble overført i det syvende århundre av Tibet til Saudi -Arabia, etter den så -kalt silkeruten.
Begrepet "Borax" var populært etter de mange applikasjonene som ble funnet og markedsført under navnet 20 Mule Team Borax Tradermax, som refererte til måten Borax ble fraktet gjennom ørkenene i Nevada og California.
En annen versjon av oppdagelsen deres indikerer at egypterne hadde kjent for sin eksistens i lang tid, og brukte den i sveisene med metaller med varme. I tillegg brukte de det i medisin og i mumifiseringsprosessen. Boraks ble overført til Europa i det trettende århundre av Marco Polo.
I midten av nittende århundre ble store boraksforekomster oppdaget i Magove -ørkenen, noe som gjorde bruken av bruken av siden den gang.
Boraksstruktur
 Boraksionstruktur. Kilde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Boraksionstruktur. Kilde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Det overordnede bildet viser ionene som utgjør boraksen, spesielt tilsvarende et fast stoff med en komposisjonsformel av Na2[B4ENTEN5(ÅH)4] · 8H2Eller (eller na2B4ENTEN7· 10H2ENTEN).
For det første kan burstrukturen til anionen bli lagt merke til [b4ENTEN5(ÅH)4]2- (Selv om jeg burde ha to grupper-), der en åttekantet ring (fire atomer av B og fire av O) kan sees), med en B-O-B-bro som deler den i to halvdeler.
Kan tjene deg: alkaliske løsninger: Definisjon, egenskaper og bruksområderDette buret forblir ikke statisk, men vibrerer og vedtar forskjellige konformasjoner i verdensrommet; Imidlertid i mindre grad i nærheten av broen. Det kan også legges merke til at det er veldig "oksygenert"; Det vil si at den har mange oksygenatomer, i stand til å samhandle med vannmolekyler ved bruk av hydrogenbroer.
Det er ikke overraskende at borakskrystaller kan hydrere og generere mange hydrater. Dermed for den faste na2[B4ENTEN5(ÅH)4] · 8H2Eller det er åtte H -molekyler2Eller samhandle med Borarate Cage, og samtidig med NA -metallsentrene+.
På kationsiden har du det vandige komplekset [Na (h2ENTEN)4]+n, hvor verdien av n vil avhenge av anion/kation -andelen. I det øvre faststoffet, n = 2, så du har: [Na2(H2ENTEN)8]2+, hvis belastning 2+ nøytraliserer belastningen 2- av Borarate-anionen.
Krystaller
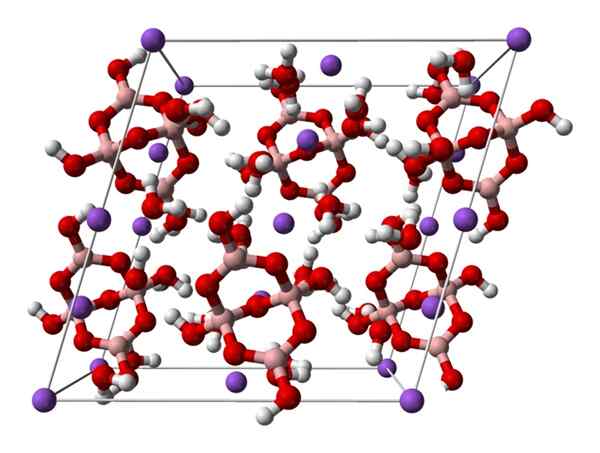 Borax monoklinisk celle. Kilde: Ben Mills [offentlig
Borax monoklinisk celle. Kilde: Ben Mills [offentligDomene].
Opp2[B4ENTEN5(ÅH)4] · 8H2Eller eller na2B4ENTEN7· 10H2ENTEN. Her styrer eller dominerer elektrostatiske attraksjoner og hydrogenbroer eller dominerer de strukturelle mønstrene i hvert glass av glasset.
Andre hydrater og vannfri salt mister en eller alle vannmolekylene sine, og endrer sammensetningen og strukturen til borakskrystallen. Hos dem alle forblir anion og kation den samme (med mindre det er urenheter eller laterale reaksjoner), så forvirring kan ikke genereres.
Forvirringer med Boraato -anionen
Na2[B4ENTEN5(ÅH)4] · 8H2Eller og na2B4ENTEN7· 10H2Eller de er de samme. Fordi?
For det første, hvis atomene deres blir talt, vil de se at de sammenfaller i antall; Og for det andre i anion B4ENTEN72- Fraværet av de to OH-gruppene som er knyttet til borhodene til B-O-B-broene, vurderes; to å det sammen med de to h+ fra b4ENTEN72-, Legg opp til 2 timer2Eller, gir totalt 10 timer2O (8 + 2).
Egenskaper
Navn
- Borax.
- Natriumborarat.
- Natrium tetraborert.
- Datorbar tetaborat.
Molekylmasse
Anhydro: 201,22 g/mol.
Decohydrat: 381,38 g/mol.
Fysisk utseende
Et krystallinsk hvitt fast stoff.
Tetthet
Vannfri: 2,4 g/cm3
Decahixture: 1.739 g/cm3
Smeltepunkt
Anhidro: 743 ºC (1.369 ºF, 1.016 K).
Decohydrat: 75 ºC.
Kokepunkt
Anhidro: 1.575 ºC (2.867 ºF, 1.848 K).
Vannløselighet
31,78 g/l (begge for vannfri og forfallsroper).
Løselighet i organiske løsningsmidler
Det er veldig løselig i etylenglykol, moderat oppløselig i dietylenglykol og metanol, og litt oppløselig i aceton.
Refraction Index (ηd)
Anhidro: η1 = 1.447; η2 = 1.469.
Forfalledrado: η2 = 1.472.
Stabilitet
Det er stabilt under tilstrekkelige lagringsforhold. Selv om det har et lavt damptrykk, øker det med temperaturen, forårsaker krystallisering og kondens, så overdreven temperatur og fuktighetssvingninger bør unngås.
Lysutslipp
Natriumetetaboratet når den utsettes for brann, avgir et grønt lys.
Reaksjoner
- Når du oppløses i vannet, har alkaliske løsninger med en pH rundt 9,2.
- Borax reagerer på å danne andre borater, for eksempel perborate (PBS).
- Den produserer også borsyre når den reagerer med saltsyre:
Na2B4ENTEN7· 10H2O + HCl => 4 H3Bo3 + 2 na+ + 2 Cl- + 5 H2ENTEN
- Natriumetetaborat oppfører seg som et amfohete -stoff, siden det i vandig oppløsning hydrolyseres og er i stand til å nøytralisere syre. På samme måte er den i stand til å nøytralisere høykonsentrasjonsalkalier, og unngå overdreven forhøyelse av medium pH.
Kan tjene deg: primær alkohol: struktur, egenskaper, nomenklatur, eksemplerapplikasjoner
Borax har mange applikasjoner, både i mennesket og i settet med aktiviteter som den utfører.
Antioksidanthandling
Borax har muligheten til å oppløse oksider. Av denne grunn brukes det i utvinning av metaller som messing, kobber, bly og sink.
Det brukes også til å forhindre oksidasjon av metallstenger i fundamentene. Boraks dekker overflaten, unntatt luften, og derfor unngå oksidasjon. I tillegg forhindrer det korrosjon av jernholdig materiale i bilproduksjon.
Boraksløselighet i etylenglykol har vært nyttig i frostvæskeformuleringer. Boraks nøytraliserer det sure avfallet som produseres under nedbrytning av etylenglykol, og minimerer oksidasjonen som overflaten av metaller kan lide.
Utdyping av lim
- Borax er en del av en limformulering for bølgepapir og papp.
- Det er et peptiseringsmiddel i fremstilling av lim basert på kasein og dekstrin.
- Handler styrking av limmaterialer ved å krysse de konjugerte hydroksilgruppene.
Brannhemmende
Det brukes som et brannhemmende middel i cellulosematerialer og andre polymerer som inneholder hydroksiljegrupper. Den utøver sin handling gjennom flere mekanismer, inkludert dannelse av et glassaktig lag som begrenser tilgangen til drivstoff.
Borosilisert glassutslipp (Pyrex)
Borax er en kilde til bor brukt i utdypingen av borosilisert glass; Karakterisert av et høyt fusjonspunkt, lav ekspansjonskoeffisient og høy motstand mot termiske støt.
Dette lar deg bli utsatt for høye temperaturer uten å oppleve brudd, og mottar den ildfaste glass -kirkesamfunnet.
Borosilisert glass brukes til utdyping av materialer som skal brukes hjemme for å bake mat. Det brukes også på laboratorium i beger, fixolas, måler sylindere, pipetter, etc.
Emulgator
Boraks, sammen med andre forbindelser, brukes til å emulge såper og andre parafiner. Det brukes også som grunnlag for utdyping av kremer, kremer og salver.
Rengjøringsmateriale
- Det legges til i formuleringene for å rengjøre faste overflater som metaller, glass og keramikk.
- Det brukes i håndrensere, poleringsmateriale og vaskemiddel såper av bruk i vaskerier og hjem. I tillegg letter det fjerning av fete forekomster fra fabrikkens etasjer.
Medisinsk bruk
- Det brukes i behandlingen av føtters soppinfeksjoner.
- Det er en del av næringsformelen som leverer bor. Dette elementet antas å gripe inn i kalsium, fosfor og magnesiummetabolisme, og være nødvendig for beinstruktur.
- Det griper inn i bestemmelsen av glykosylert hemoglobin (HBA1c), bevis som tjener til å kjenne utviklingen av langvarig diabetes hos en pasient, siden halvlivet for en erytrocytt er 120 dager.
Denne informasjonen er mer nyttig for legen enn isolerte bestemmelser av pasientens blodsukker.
PH støtdemper
Det brukes i flere pH støtdempere brukt i biokjemi; Blant dem er Tris (hydroksymetyl) aminometan-boray, brukt i elektroforese i polyakrylamid av DNA og RNA-nukleinsyrer.
Reduksjon i vannhardhet
Borax er i stand til å kombinere med kalsium- og magnesiumioner som er til stede i vannet, og reduserer konsentrasjonen. På denne måten reduseres hardheten i vannet.
Kan tjene deg: kaliumhydroksyd: struktur, egenskaper, brukGjødsel og gjødsel
Boraks brukes som en kilde til bor. Kalsium og bor er involvert i dannelsen av plantenes cellevegg. I tillegg har det blitt påpekt at bor favoriserer pollinering, så det griper inn i befruktning og spredning av planter.
Bevaring av tre
Borax kjemper mot Woodwood, en bille som bruker og ødelegger treverket. Det brukes også i bevaring og vedlikehold av treskip.
Grunnleggelse og flyt
Det brukes som grunnlegger innen stål- og jernsveising, noe som forårsaker en reduksjon i smeltepunktet og eliminering av jernoksid; En uønsket miljøgifter. Med en lignende ende deltar den i sveising av gull og sølv.
Andre
- Det brukes som et mykt plantevernmiddel; For eksempel for kampen av møll i ull.
- Sprayet serverer for kontroll av skadedyr som er til stede i skap, indre avsetninger, i veggens hull, og generelt, hvor bruk av mer forurensende plantevernmidler ikke er ønsket.
- Det brukes i kjernefysiske reaktorer for å kontrollere reaksjoner som i ekstreme tilfeller kan gi en kjedereaksjon.
- I biler radiatorer brukes borax for å få stedene der det er vann som rømmer.
Syntese
Borax oppnås ved react5ENTEN9.8H2Eller, med natriumkarbonat og natriumhydrokarbonat i vandig medium.
Egentlig brukes syntesen av natrium eller boraks -tetabrorat lite; Det meste av den produserte forbindelsen oppnås ved utvinning av mineralene som inneholder den.
Prosessen kan oppsummeres i en løsning av malmen i vann, etterfulgt av en leirfiltrering og til slutt en fordampning av den vandige løsningen.
Risiko
Borax er et naturlig produkt, men det kan produsere en serie helseskader hos mennesker. På grunn av kontakt med støvstøvet kan for eksempel irritasjon av huden som kan forårsake dermatitt.
På samme måte produserer boraks irritasjon i øynene og øvre luftveier. Blant symptomene på dens innånding er det hoste og halssmerter.
I mellomtiden presenterer boraksinntak følgende symptomer: oppkast, kvalme, diaré, sagging, hodepine og anfall. I tillegg kan en påvirkning av sentralnervesystemet og nyrefunksjon oppstå.
Fra studier utført hos hann -sex -rotter, matet med boraks, ble testikulær atrofi observert. Mens studier utført med gravide hunnrotter påpekte at boraks kunne krysse morkaken, og ga en endring av fosterutvikling, manifestert ved lav fødselsvekt.
Det antas at eksponering for boraks kan påvirke mannlig reproduktiv funksjon hos mennesker, manifestert ved en reduksjon i sædtelling.
En dødelig dose på 10 til 25 gram er estimert for boraksinntak hos voksne.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Nasjonalt senter for bioteknologiinformasjon. (2019). Argon. PubChem -database. CID = 23968. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Karolyn Burns, Seneca Joseph, & DR. Ryan Baumbach. (s.F.). Syntese og egenskaper ved borakskrystaller og intermetallliske legeringer. Gjenopprettet fra: NationalMaglab.org
- Wikipedia. (2019). Borax. Hentet fra: i.Wikipedia.org
- Rio Tinto. (2019). Boraksdehydrat. 20 Mule Team Borax. Gjenopprettet fra: Borax.com
- Fletcher Jenna. (14. januar 2019). Er boraks trygt å bruke? Gjenopprettet fra: MedicalNewStody.com
- « Kromklorid (CRCL3) struktur, egenskaper, bruk
- Transgene mategenskaper, fordeler, eksempler, konsekvenser »

