Aluminiumbromid
- 3547
- 286
- Marius Aasen
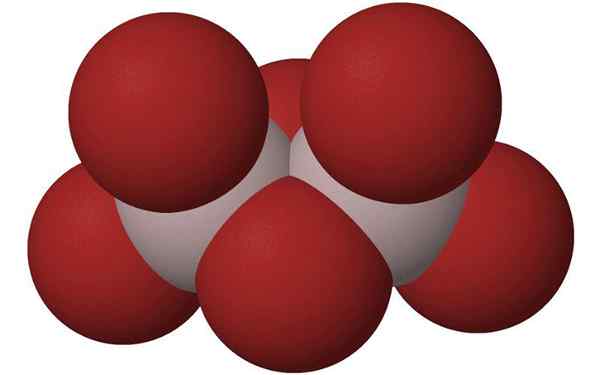
 Sfærer av aluminiumbromiddimeren. Kilde: HOA112008, Wikimedia Commons
Sfærer av aluminiumbromiddimeren. Kilde: HOA112008, Wikimedia Commons Hva er aluminiumbromid?
Han Aluminiumbromid Det er en forbindelse dannet av et aluminiumatom og en variert mengde bromatomer. Det dannes avhengig av mengden valenselektroner som aluminium har.
Å være en forbindelse festet av et metall (aluminium) og en ikke -metall (brom), dannes kovalente bindinger som gir strukturer en veldig god stabilitet, men uten å nå den av en ionisk binding.
Aluminiumbromid er et stoff som normalt presenteres i en fast tilstand, med en krystallinsk struktur. Fargene på de forskjellige aluminiumsbromuros fremstår som bleke gule av forskjellige nyanser, og noen ganger presenteres det uten tilsynelatende farge.
Fargen avhenger av kapasiteten for lysrefleksjon som forbindelsen har og endres avhengig av strukturer som er opprettet og formene den tar.
Den faste tilstanden til disse forbindelsene krystalliserer seg, så de har godt definerte strukturer med et utseende som ligner på havsalt, men varierer fargen deres.
Formel
Aluminiumbromid består av et aluminiumsatom og av forskjellige mengder brom (BR) atomer, avhengig av valenselektronene som har aluminium.
Derfor kan den generelle formelen for aluminiumbromid skrives som følger: ALBx, Hvor "x" er antallet bromatomer som binder seg til aluminium.
Den vanligste måten den blir presentert på er som2Br6, som er et molekyl med to aluminiumatomer som hovedbaser i strukturen.
Kan tjene deg: laktofenol blå: egenskaper, sammensetning, forberedelse, brukKoblingene mellom dem er dannet av to bromer i midten, slik at hvert aluminiumatom har fire bromatomer i sin struktur, men på sin side deler to to.
Egenskaper og egenskaper ved aluminiumbromid
- På grunn av sin natur er den svært løselig i vann, men den er også delvis oppløselig i forbindelser som metanol og aceton, i motsetning til andre stoffer.
- Den har en molekylvekt på 267 g/mol og dannes av kovalente bindinger.
- Natriumbromid når sitt kokepunkt ved 255 ° C, og når smeltepunktet ved 97.5 ° C.
- Et annet kjennetegn ved denne forbindelsen er at den avgir giftstoffer når den fordamper, så det ikke er tilrådelig.
applikasjoner
- En av bruksområdene som er gitt til denne typen stoffer, på grunn av dets metalliske og ikke -metalliske natur, er av midler i kjemiske tester av renhet. Disse renhetstestene er veldig viktige for å bestemme kvaliteten på reagenser og lage produkter som folk er fornøyde.
- I vitenskapelig forskning brukes det på en veldig variabel måte. For eksempel for å danne komplekse strukturer, midler i syntesen av andre kjemikalier av verdi, i hydrogenering av dihydroxinaftalener og i selektivitet i reaksjoner, blant annet bruk.
- Denne forbindelsen er ikke populær kommersielt. Som sett over har den noen applikasjoner som er veldig spesifikke, men veldig interessante for det vitenskapelige samfunnet.
Referanser
- Chang, R. (2010). Kjemi. McGraw-Hill Inter-American.
- Krahl, t., & Kemnitz, og. (2004). Amorf eiringum bromid fluor (ABF). Angewandte Chemie - International Edition.

