Svak syre
- 1008
- 43
- Jonathan Moe
 Svake syreeksempler
Svake syreeksempler Hva er en svak syre?
En svak syre er en som i vandig løsning har liten kapasitet til å dissosiere i hydrogen (H+) og i den tilsvarende konjugerte basen. I motsetning til sterke syrer, hvis dissosiasjon er fullstendig (100%) og praktisk talt irreversible, er svake syrer knapt dissosiert og reversibel.
Derfor genererer en svak syre mindre hones h+ I vann av hva som kunne forvente. Blant de mest representative svake syrene har vi eddiksyre, hovedkomponenten i eddik, som er omtrent i en 0.5 % under normale forhold.
Dette betyr at den største andelen av en eddiksyreoppløsning i vann, for eksempel 5%kokeeddik, er i ikke -dissosiert form (CH3Cooh); Mens en liten del er funnet som konjugatbasen (velg3COO-), ledsaget av H -ioner+, eller mer korrekt, H -ioner3ENTEN+.
Etter hvert som mengden hydrogen som frigjøres med en svak syre i vandig løsning er lav, er pH de produserer høyere (basisk) enn den som produseres av en sterk syre. For eksempel har eddik en pH på 2.5, appelsinjuice pH 3.3. 4.2 og 2 sitronsaft på 2.
Disse pH -ene, selv om de er sure, er høyere enn pH som produserer en løsning av en sterk syre (HCl, H2SW4, etc.) at de kan nå verdien av 1 eller mindre (negative pH -verdier).
Kjennetegn på svake syrer
pH i løsningene dine
Svake syrer har vanligvis en pH mellom 2.0 og mindre enn 7.0, så de snur fargen på pannasolpapiret i rødt. Disse pH -verdiene er mange høyere enn pH -verdiene produsert av sterke syrer, selv om det er unntak.
For eksempel har en 1 mM saltsyreoppløsning (en sterk syre) en pH på 3.0, mens en 1 mm løsning av fluorhorinsyre (en "svak" syre), har en pH på 3.2, som er nær sterk syre.
Delvis ionisering
Svake syrer i oppløsningen er ionisert lite eller delvis i vann, og dissosierer i den konjugerte basen av syre og hydrogenion. Deretter blir en svak syre i vandig løsning for det meste dissosiert, med en liten dissosiert andel.
Kan tjene deg: balansering av kjemiske ligningerNår mengden hydrogen frigjort av en svak syre i vann er lav, er pH produsert av denne syren høyere enn den produseres av en sterk syre oppløst i vann, siden disse vanligvis er ionisert med 100 %.
Reversibel ionisering
Ioniseringen av en svak syre blir vanligvis skjematisert som følger:
Har ⇌ a- + H3ENTEN-
Hvor er det svak syre, til- dens konjugerte base, og h3ENTEN+ hydroniumkationen, som er veien i h+ Det eksisterer eller manifestert i vannet. Konsentrasjonen (eller aktiviteten) av h3ENTEN+ Det brukes i stedet for h+ For bestemmelse av løsningen av løsningen.
Ioniseringsgrad
Noen syrer er svakere enn andre, noe som er det samme å si, de er mindre ioniserte. Derfor tillater ioniseringsgraden oss å skimte hvor sur syre under visse forhold er.
For å uttrykke graden av ionisering ble flere parametere introdusert, for eksempel ionisering eller surhetskonstant (Ka) og PKA: en måte å uttrykke KA i et enkelt tall som utelater bruken av et tall uttrykt i negative krefter på ti (10 (10 ), som det eksisterer i KA.
KA- og PKA -konstanter brukes hovedsakelig til svake syrer.
Ka = [a-] [H+] / [Ha]
Beslagene som er til stede i formelen representerer konsentrasjoner.
pka = - log ka
PKA -verdien av en svak syre varierer vanligvis mellom 2 og 12. Men det er unntak. For eksempel: og og odagisk syre (hio3) har en PKA på 0.77, som regnes som en relativt liten verdi, men uten å være negativ, for en svak syre i streng forstand.
Konjugatbasestabilitet
Svake syrer har en sterk binding med surt hydrogenatom (hΔ+-XΔ-), så de har en lav grad av dissosiasjon av hydrogen. Dette resulterer i den konjugerte basen av svak syre har stor aviditet ved hydrogen, og er en sterk konjugert base.
Kan tjene deg: kolloidDet vil si at den konjugerte basen til en svak syre er veldig ustabil, fordi den aksepterer h+ kom veldig enkelt tilbake. Jo mer ustabil denne konjugerte basen, jo svakere vil syren være i spørsmål.
Lav ionisk konduktivitet
Å være lite ioniserte, svake syrer er dårlige strømledere, i motsetning til sterke syrer som er gode strømledere.
Tilstedeværelse i naturen
Svake syrer er vidt distribuert i naturen, for eksempel er de i sitrusfrukter (sitron, grapefrukt, oransje osv.).
De er også til stede i en rekke prosesser som oppstår i alle levende vesener. Noen av disse biologiske svake syrene er pyruviske, melkes, sitron, fumarisk, suksinisk, glutamisk, etc., og til og med oksygenert hemoglobin frigjør hydrogenjoner, så det oppfører seg som en svak syre.
Deretter kan det konkluderes med at mennesket bor i permanent kontakt med svake syrer.
Hvordan beregne pH for en svak syre?
PH for en svak syre kan beregnes ved å bruke syrekonstanten (Ka), eller ved å bruke Henderson-Haselbalch-ligningen. I det første eksemplet vil Ka bli brukt.
Med surhet konstant
Beregn pH i en løsning 0.5 m benzosyre (C6H5COOH), som har en ioniseringskonstant (Ka) = 1.8 x 10-5
C6H5COOH ⇌ c6H5COO- + H+ (1)
Hvis mengden syre som dissosierer kalles x, så 0.5 M-x vil være konsentrasjonen av svak syre som ikke.
Ligning (1) kan være representert som følger:
0.5 m-x ⇌ x +x
Svake syrer ioniseres i en veldig lav andel, så konsentrasjonen av benzosyre i balansen på (0.5 m-x), kan antas som 0.5 m, siden x <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5m
X2 = (1.8 x 10-5) (0.5m)
X = 3 x 10-3 M
Derfor [h+] er lik 3 x 10-3 M. Vi løser da ved å beregne pH:
Det kan tjene deg: MOHR -metode: grunnleggende, reaksjoner, prosedyre, brukpH = - log [h+]
= - Logg [3 x 10-3]
pH = 2.52
Merk at pH er relativt sur, da den ligger under 3 eller 4.
Med Henderson-Haselbalch-ligning
Henderson-Haselbalch-ligning brukes til å beregne pH i en bufferløsning:
pH = PKA + log [konjugert base] / [syre]
Eksempel:
Natriumhydroksyd (NaOH) tilsettes en eddiksyreoppløsning, og produserer en sluttkonsentrasjon av eddiksyre (CH3COOH) 1.11 x 10-2 mol/l og en konjugatbase -konsentrasjon (velg3COO-) av 0.44 x 10-2 mol/l. Hvis eddiksyre PKA er 4.75 Beregn pH i løsningen.
pH = 4.75 +log [a-] / [Ha]
pH = 4.75 +log (0.44 x 10-2 / 1.11 x 10-2)
= 4.75+ log 0.396
= 4.348
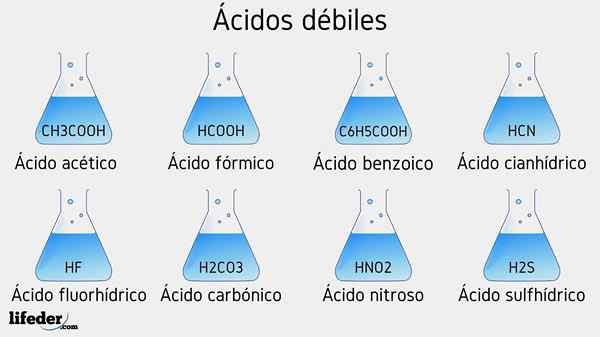
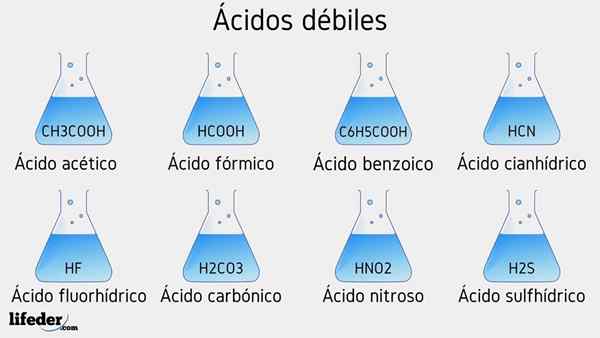
Svake syreeksempler
Flere svake syrer ledsaget av PKA -verdiene deres vil bli listet opp nedenfor:
- Ch3COOH (eddiksyre), PKA 4.75
- HCOOH (maursyre), PKA 3.74
- C6H5COOH (benzosyre), PKA 5.59
- Ch2Clcooh (kloreddiksyre), PKA 2.85
- HCN (cyanhydrikkyre), PKA 9.31
- Hf.17
- C2H5COOH (propionsyre), PKA 4.89
- Hno2 (Lystgallsyre), PKA 3.35
- H2S (sulfidsyre), PKA1 6.0 og PKA2 12.92
- CCL3COOH (trikloreddiksyre), PKA 0.52
- H2Co3 (Kullsyre), PKA1 6.37 og PKA2 10.22
- H3Po4 (fosforsyre), PKA1 2.12, PKA2 4.21 og PKA3 elleve.0
- C6H5SW3H (benzefonsyre), PKA 0.70
- HIO3 (Yodium acid), pka 0.77
- Hclo2 (Chloros acid), PKA 2.0
- Ch3Ch2(OH) COOH (melkesyre), PKA 3.08
Svake syrer med terapeutisk bruk
- Salisylsyre, PKA 3.00
- Acetylsalisylsyre, PKA 3.49
- Furosemide, PKA 3.90
- Ibuprofen, PKA 4.40
- Levodopa, PKA 2.30
- Fenobarbital, PKA 7.40
- Warfarina, PKA 5.0
- Teofilina, PKA 8.80
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Morris, J. G. (1974). Fysikjemi for biologer. (2. utg.). Jeg snudde meg.
- Helmestine, Anne Marie, PH.D. (29. august 2020). Svak syredefinisjon og eksempel i kjemi. Gjenopprettet fra: Thoughtco.com
- Ophardt c., & McCarthy L. (15. august 2020). Syre og basestyrke. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Clark Jim. (2013). Sterk og svak syre. Gjenopprettet fra: Chemguide.co.Storbritannia
- Lumen -læring. (s.F.). Kjemi for ikke-major: Beregning av pH av svak syre- og baseløsninger. Gjenopprettet fra: kurs.Lumenarning.com

