Butanal struktur, egenskaper, bruksområder og risikoer
- 4140
- 1310
- Jonathan Moe
Han Butanal Det er en åpenkjede aldehyd, bestående av fire karbonatomer, og er analog med butanen; Det er faktisk den nest mest oksiderte formen for butanhydrokarbon etter smørsyre. Den molekylære formelen er cho3Ch2Ch2Cho, hvor -cho er formilgruppen.
Dette aldehydet, en av de letteste, består av en gjennomsiktig, brennbar og mindre tett væske enn vann. I tillegg er det løselig i vann og blandbar med de fleste organiske løsningsmidler; Derfor kan det brukes til å ha en -fase organiske blandinger.
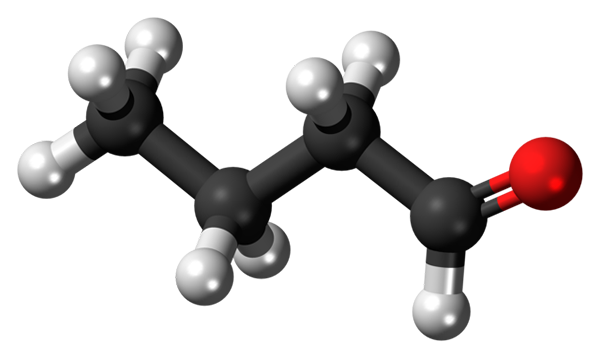
 Butanal eller butiraldehydmolekyl. Kilde: Jynto [CC0]
Butanal eller butiraldehydmolekyl. Kilde: Jynto [CC0] Tilstedeværelsen av karbonylgruppen (den røde sfæren, overlegen bilde) gir kjemisk polaritet til butanalmolekylet, og derfor evnen til å oppleve dipol-dipolo-interaksjonen mellom molekylene; Selv om det ikke dannes hydrogenbroer mellom dem.
Dette gir som en konsekvens av at den butanale nåværende koke- og fusjonspunktene er større enn butan, men mindre enn de som er presentert av N-Boutyl Alcohol.
Butanal brukes som et løsningsmiddel og er mellomledd for å oppnå mange produkter; som akseleratorer av vulkanisering av gummi, harpikser, farmasøytiske og agrokjemiske produkter.
Butanal er en giftig forbind.
[TOC]
Butanal struktur
Det har nettopp blitt nevnt at Formil -gruppen, -CH. Som et resultat av dette kan molekylene deres samhandle med hverandre gjennom dipol-dipolo-krefter.
Kan tjene deg: roterende tørketrommel: drift, hva er det for, deler, applikasjonerI det øvre bildet vises det, med en modell av kuler og stenger, at butanalmolekylet har en lineær struktur. Gruppens karbon -cho har SP -hybridisering2, Mens de gjenværende karbonatomer3.
Ikke bare det, men det er også fleksibelt, og koblingene deres kan rotere på sine egne akser; Og dermed genereres forskjellige konformasjoner eller konformere (samme forbindelse, men med deres roterte lenker).
Conformeros
Følgende bilde forklarer dette poenget best:
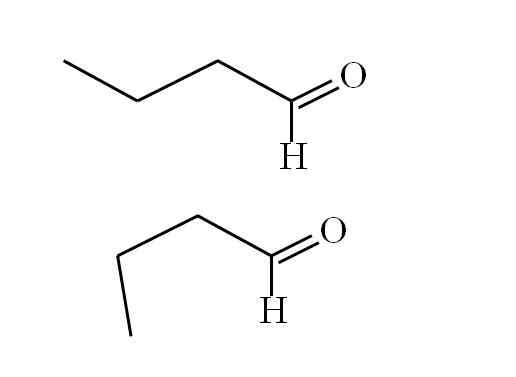 Butanal konform. Kilde: Gabriel Bolívar.
Butanal konform. Kilde: Gabriel Bolívar. Den første konformeren (den overordnede) tilsvarer molekylet til det første bildet: metylgruppen til venstre, -CH3, og gruppen -cho, er i parallelle posisjoner; den ene peker opp, og den andre nedover henholdsvis.
I mellomtiden tilsvarer den andre konformatoren (den nedre) molekylet med -CH3 og -ho i formørkede posisjoner; det vil si begge peker i samme retning.
Begge konformatorene er raskt utskiftbare, og derfor roterer butanalmolekylet og vibrerer konstant; Og la til det faktum at han har en permanent dipol, dette gjør at interaksjonene hans kan være sterke nok til å koke ved 74,8 ºC.
Egenskaper
Kjemiske navn
-Butanal
-Butiraldehyd
-1-butanal
-Butiral
-N-Butiraldehyd.
Molekylær formel
C4H8Eller Ch3Ch2Ch2Cho.
Fysisk utseende
Det er en klar, gjennomsiktig væske.
Lukt
Karakteristisk lukt, dekar, aldehyd.
Kokepunkt
167 ºF ved 760 mmHg (74,8 ºC).
Smeltepunkt
-146 ºF (-96,86 ºC).
tenningspunkt
-8 ºF (-22 ºC) lukket glass.
Vannløselighet
7 g/100 ml ved 25 ºC.
Løselighet i organiske løsningsmidler
Blandbar med etanol, eter, etylacetat, aceton, toluen og mange andre organiske løsningsmidler.
Tetthet
0,803 g/cm3 ved 68 ºF.
Kan tjene deg: nitrater: egenskaper, struktur, nomenklatur, treningDamptetthet
2,5 (i luftforhold tatt lik 1).
Damptrykk
111 mmHg ved 25 ºC.
Selvretning
446 ºF. 425 ºF (21,8 ºC).
Goo
0,45 cpoise ved 20 ºC.
Forbrenningsvarme
2479,34 kJ/mol ved 25 ° C.
Fordampningsvarme
33,68 kJ/mol ved 25 ° C.
Overflatespenning
29,9 Dina/cm a 24 ºC.
Lukt terskel
0,009 ppm.
Brytningsindeks
1.3843 til 20 ºC.
Dipolar øyeblikk
2,72 d.
Bølgelengder (λ) av maksimal absorpsjon i vann
225 nm og 282 nm (ultrafiolett lys).
Polymerisasjon
Butanal kan polymerisere i kontakt med alkalier eller syre, og være farlig polymerisasjon.
Reaktivitet
Når den er utsatt for luft oksidert, danner du smørsyre. Ved en temperatur på 230 ºC er butanal spontant betent med luften.
Aldolisk kondens
To butanale molekyler kan reagere på hverandre, i nærvær av KOH og en temperatur på 6-8 ºC, for å danne forbindelsen 2-etyl-3-hydroksyhexanol. Denne sammensatte typen kalles Aldol, siden den har en aldehydgruppe og en alkoholholdig gruppe i sin struktur.
Syntese
Butanal kan oppstå ved katalytisk dehydrogenering av N-butylalkohol; katalytisk hydrogenering av crotonaldehyden; og propylenhydroformilering.
applikasjoner
Industriister
-Butanal er et industrielt løsemiddel, men det er også mellomledd i syntesen av andre løsningsmidler; For eksempel 2-etylhexanol, n-butanol og trimetylpropan.
-Det brukes også som mellomledd i utdyping av syntetiske harpikser, blant dem, butiral polyvinil; Akselerere av vulkaniseringen av gummi; produksjon av farmasøytiske produkter; produkter for avlingsbeskyttelse; plantevernmidler; antioksidanter; Skarpende assistenter.
-Butanal brukes som råstoff for utdyping av syntetiske aromaer. I tillegg brukes det som et matsmaksmiddel.
Det kan tjene deg: natriumbromid (NABR)Andre
-Hos mennesker brukes butanal som en biomarkør som indikerer oksidasjonsskader, opplevd av lipider, proteiner og nukleinsyrer.
-Det ble brukt eksperimentelt, sammen med Formaline og Gluterdehyd, for å prøve å redusere mykgjøringen som ble opplevd av storfekjøtthjelmer, på grunn av eksponering for vann, urin og avføring av storfe selv. Eksperimentelle resultater var positive.
Risiko
Butanalen er ødeleggende for slimhinnene i de øvre luftveiene, så vel som for hud- og øynevev.
Ved kontakt med huden produserer rødhet og forbrenninger. I øynene produseres de samme lesjonene, ledsaget av smerter og skade på det okulære vevet.
Butanal innånding kan ha alvorlige konsekvenser, siden det kan gi i strupehodet og betennelse og ødembronkialer; Mens det er i lungene, produserer det kjemisk lungebetennelse og lungeødem.
Overeksponeringstegnene omfatter: Ardor -sensasjoner på øvre luftveier, hoste, tungpustethet, det vil si utslipp av fløyte når du puster; Laryngitt, mangel på pust, hodepine, kvalme og også oppkast.
Innånding kan være dødelig som et resultat av spasmen i reparasjonsveiene.
Butanal inntak forårsaker en følelse av "forbrenning" på fordøyelsesveier: munnhulen, farynx, spiserør og mage.
Referanser
- Morrison, r. T. Og Boyd, r. N. (1987). Organisk kjemi. (5ta Utgave.). Redaksjonell Addison-Wesley Iberoamericana.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Pubchem. (2019). Butanal. Gjenopprettet fra: Pubchem.NCBI.Nim.NIH.Guv
- Wikipedia. (2019). Butanal. Gjenopprettet fra: er.Wikipedia.org
- Kjemisk bok. (2017). Butanal. Gjenopprettet fra: ChemicalBook.com
- Basf. (Mai 2017). N-butyraldehyd. [PDF]. Hentet fra: løsningsmidler.Basf.com
- « Primære karbonegenskaper, typer og eksempler
- Integrerte utdanningskarakteristikker og hvordan du skal oppnå det »

