Ceped varmeformler, hvordan du beregner det og løste øvelser

- 1151
- 160
- Markus Fredriksen
Han Avsagt varme Det er overføring av energi mellom to kropper ved forskjellige temperaturer. Den som er høyere temperatur gir varme til den hvis temperaturen er lavere. Enten en kropp gir eller absorberer varme, dens temperatur eller dens fysiske tilstand kan variere avhengig av massen og egenskapene til materialet det er laget.
Et godt eksempel er i en kopp dampende kaffe. Skje med metall som sukker blir omrørt. Hvis den blir liggende inne i koppen nok tid, vil kaffe og metallteskje ende. Noe varme vil ha gått til miljøet, siden systemet ikke er isolert.
 Kaffen og teskjeen blir i termisk likevekt en stund. Kilde: Pixabay.
Kaffen og teskjeen blir i termisk likevekt en stund. Kilde: Pixabay. Når temperaturene samsvarer, er termisk likevekt.
Hvis den samme testen ble utført med en plastteskje, vil den sikkert merke at den ikke varmer opp så raskt som metall, men til slutt vil den også bli i balanse med kaffe og alt som omgir den.
Dette er fordi metallet fører varmen bedre enn plasten. På den annen side gir det sikkert kaffe i en annen hastighet enn varm sjokolade eller annen drikke. Deretter avhenger varmen som er tildelt eller absorbert av hvert objekt av hvilket materiale eller stoff som er laget.
[TOC]
Hva er og formler
Varme refererer alltid til strømmen eller transitt av energi mellom ett objekt og et annet, på grunn av temperaturforskjellen.
Det er grunnen til at det er snakk om varme tildelt eller absorbert varme, siden ved å tilsette eller trekke ut varme eller energi på noen måte, er det mulig å endre temperaturen på et element.
Det kalles vanligvis mengden varme som den hotteste objektet gir. Denne verdien er proporsjonal med massen til nevnte objekt. En kropp med stor masse er i stand til å gi opp mer varme enn en annen av mindre masse.
Kan tjene deg: Millikan Eksperiment: Prosedyre, forklaring, betydningTemperaturforskjellen Δt
En annen viktig faktor i beregningen av den tilordnede varmen er temperaturforskjellen som objektet som gir varmeopplevelsene. Det er betegnet som ΔT Og det beregnes slik:
Δt = tF - Tenten
Til slutt avhenger mengden av tilordnede varme Spesifikk varmevarme, betegnet som c.
Så endelig er uttrykket for den tilordnede varmen som følger:
QSceding = - m.c.ΔT
Utbyttet er symbolisert med et negativt tegn.
Den spesifikke varme- og varmekapasiteten til et stoff
Den spesifikke varmen er mengden varme som er nødvendig for å øke temperaturen på 1 g stoff med 1 ° C. Det er en egen egenskap av materialet. Enhetene i det internasjonale systemet er: Joule/kg . K (Joule mellom kilo x temperatur i grader Kelvin).
Varmekapasiteten C er et koblet, men litt annet konsept, siden objektets masser griper inn. Varmekapasitet er definert som følger:
C = MC
Dets enheter i S.Yo. De er Joule/K. Slik at den avsatte varmen også kan uttrykkes like:
Q = -C. ΔT
Hvordan beregne det?
For å beregne varmen tildelt av et objekt, er det påkrevd å vite følgende:
- Den spesifikke varmen på stoffet som gir varmen.
- Massen av nevnte stoff
- Den endelige temperaturen for å oppnå
De spesifikke varmeverdiene for mange materialer er blitt bestemt eksperimentelt og er tilgjengelige i tabeller.
Kalorimetri
Hvis denne verdien ikke er kjent, er det mulig å få den ved hjelp av et termometer og vann i en termisk isolert beholder: kalorimeteret. Et skjema for denne enheten er vist på figuren som følger med oppgave 1.
En prøve av stoffet er nedsenket ved en viss temperatur i en mengde vann som tidligere har målt. Den endelige temperaturen måles og med verdiene som er oppnådd, bestemmes den spesifikke varmen til materialet.
Kan tjene deg: Tilfeldig feil: Formel og ligninger, beregning, eksempler, øvelserSammenligning av resultatet med tabulerte verdier, kan det være kjent hvilket stoff det er. Denne prosedyren kalles kalorimetri.
Varmebalansen utføres ved bevaring av energi:
Q Sceding + Q Absorbert = 0
Løste øvelser
Oppgave 1
Et 0 stykke på 0.35 kg ved en temperatur på 150 ºC i 500 ml vann ved en temperatur på 25 ºC. Finne:
a) Den endelige likevektstemperaturen
b) Hvor mye varme flyter i denne prosessen?
Data
ckobber = 385 J/kg . ºC
cvann = 4180 J/kg . ºC
Vanntetthet: 1000 kg/m3
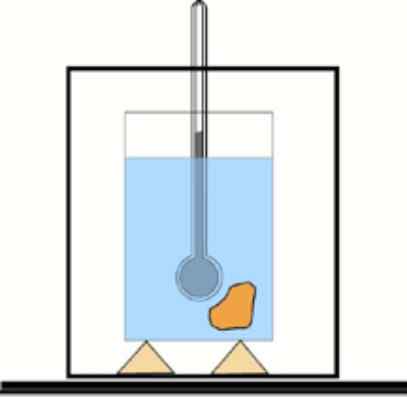 Grunnleggende kalorimeterskjema: En beholder med isolert vann og et termometer for å måle temperaturendringer. Lfiente: Dr. Tilahun Tesfaye [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Grunnleggende kalorimeterskjema: En beholder med isolert vann og et termometer for å måle temperaturendringer. Lfiente: Dr. Tilahun Tesfaye [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Løsning
a) Kobber gir varme mens vann absorberer det. Ettersom systemet anses som lukket, griper bare vann og prøve i varmebalansen:
Q Sceding = Q absorbert
På den annen side er det nødvendig å beregne massen på 500 ml vann:
500 ml = 0.5 l = 0.0005 m3
Med disse dataene beregnes massen av vannet:
masse = tetthet x volum = 1000 kg/m3 . 0.0005 m3 = 0.5 kg
Varmeligningen heves i hvert stoff:
QSceding = -Mkobber . ckobber. ΔT = -0.35 kg . 385 J/kg .ºC . (TF -150 ºC) = -134.75 (tF - 150) J
Qabsorbert = mvann . cvann. ΔT = 0.5 kg . 4186 J/kg . ºC .(TF -25 ºC) = 2093 (tF -25) J
Utjevning av resultatene du har:
2093 (tF - 25) = -134.75 (tF - 150)
Det er en lineær ligning med en ukjent, hvis løsning er:
TF = 32.56 ºC
b) Mengden varme som strømmer er varmen som er tildelt eller varmen som absorberes:
Q Sceding = - 134.75 (32.56 - 150) J = 15823 J
Q absorbert = 2093 (32.56 - 25) J = 15823 J
Oppgave 2
Et 100 g kobberstykke varmes opp i en ovn til en T -temperaturenten Og deretter introduseres det i et kobberkalorimeter på 15 g som inneholder 200 g vann ved 16 ºC. Den endelige temperaturen en gang i likevekt er 38 ºC. Når kalorimeteret og innholdet blir veid, er det funnet at jeg har fordampet.2 g vann hva var den opprinnelige temperaturen tenten?
Kan tjene deg: ormehull: historie, teori, typer, formasjonData: Den latente varmen til vanndamping er lv = 2257 kJ/kg
Løsning
Denne øvelsen skiller seg fra den forrige, siden det må vurderes at kalorimeteret også absorberer varme. Varmen tildelt av kobberstykket investeres i alt følgende:
- Varm vannet fra kalorimeteret (200 g)
- Varm kobberet som kalorimeteret er laget (150 g)
- Fordampe 1.2 gram vann (for en faseendring trenger du også energi).
QSceding = -100 x 1 x 10 -3 kg. 385 J/kg . ºC. (38 - tenten ) ºC = -38.5. (38 - tenten) J
Q absorbert av ham kalorimeter = Q absorbert av vann + Q fordampning + Q absorbert av kobber
0.2 kg .4186 J/kg ºC .(38 - 16 ºC) + 1.2 x 10-3 kg. 2257000 J/kg +0.150 kg .385 J/kg .ºC.(38 - 16 ºC) =
18418.4 +2708.4 + 1270.5 J = 22397.3 J
Derfor:
-38.5. (38 - tenten) = 22397.3
Tenten = 619.7 ºC
Varmen som er nødvendig for å bære 1 kunne også ha blitt vurdert.2 g vann opp til 100 ºC, men det er en ganske liten mengde sammenlignet.
Referanser
- Giancoli, d. 2006. Fysikk: Prinsipper med applikasjoner. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, l. 2007. Fysikk: En titt på verden. 6ta Forkortet utgave. Cengage Learning. 156 - 164.
- Rex, a. 2011. Fundamentals of Physics. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitetsfysikk med moderne fysikk. 14th. Ed. Volum 1. 556 - 553.
- Serway, r., Vulle, c. 2011. Fundamentals of Physics. 9na Cengage Learning.

