Kullsyre (H2CO3) struktur, egenskaper, syntese, bruk

- 1045
- 26
- Oliver Christiansen
Han Kullsyre Det er en uorganisk forbindelse, selv om det er de som debatterer at det faktisk er organisk, hvis kjemiske formel er h2Co3. Det er derfor en diprootisk syre, som er i stand til å donere to H -ioner+ til det vandige miljøet for å generere to molekylære kationer H3ENTEN+. Fra ham oppstår de velkjente bikarbonationene (HCO3-) og karbonat (CO32-).
Denne særegne syren, enkel, men samtidig involvert i systemer der mange arter deltar i en væskedampbalanse, dannes fra to grunnleggende uorganiske molekyler: vann og karbondioksid. Tilstedeværelsen av CO2 Unwound observeres alltid at det er en boble i vannet, og stiger opp til overflaten.
 Glass med forgasifisert vann, en av de vanligste drikkene som inneholder kullsyre. Kilde: Pxhere.
Glass med forgasifisert vann, en av de vanligste drikkene som inneholder kullsyre. Kilde: Pxhere. Dette fenomenet blir regelmessig sett i brus og kullsyreholdig vann.
Når det2 at damptrykket ditt er mer enn dobbelt atmosfæretrykk. Ved å avdekke det reduserer forskjellen i trykket inne i flasken og det ytre løseligheten av CO2, Så boblene som ender opp med å slippe unna væsken vises.
I mindre grad skjer det samme i en hvilken som helst masse friskt eller saltvann: når de varmer dem, vil de frigjøre sitt oppløste innhold av CO2.
Imidlertid CO2 Det er ikke bare oppløst, men lider transformasjoner i molekylet som gjør det til H2Co3; En syre som har et veldig lite liv, men nok til å markere en mesurabel endring i pH i det vandige løsningsmiddelmiljøet, og også generere et unikt karbonatbuffersystem.
[TOC]
Struktur
Molekyl
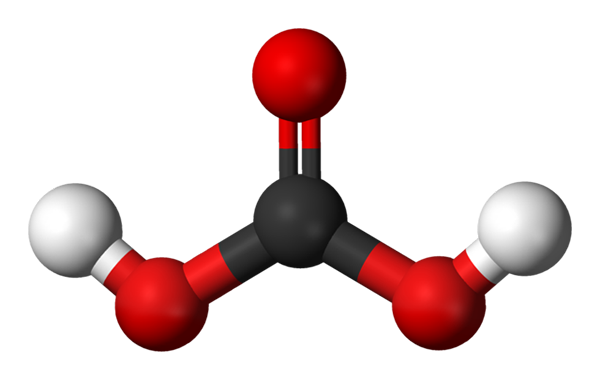 Kullsyremolekyl representert med en kuler og bar -modell. Kilde: Jynto og Ben Mills via Wikipedia.
Kullsyremolekyl representert med en kuler og bar -modell. Kilde: Jynto og Ben Mills via Wikipedia. UP har vi H -molekylet2Co3, representert med sfærer og barer. De røde kulene tilsvarer oksygenatomer, svart til karbonatom og hvite hydrogenatomer.
Merk at du starter fra bildet du kan skrive en annen gyldig formel for denne syren: CO (OH)2, der CO blir karbonylgruppen, C = O, knyttet til to hydroksylgrupper, OH. Når det er to OH -grupper, som er i stand til å donere hydrogenatomer, er det nå forstått hvor H -ionene kommer fra+ Utgitt i midten.
 Molekylær struktur av kullsyre.
Molekylær struktur av kullsyre. Merk at formelen CO (OH)2 Det kan skrives som Ohcooh; det vil si av RCOOH -typen, der R blir i dette tilfellet en OH -gruppe.
Det er av denne grunn, i tillegg til det faktum at molekylet består av oksygen, hydrogen og karbonatomer, for vanlig i organisk kjemi, at kullsyre anses av noen som en organisk forbindelse. Imidlertid, i delen av syntesen, vil det bli forklart hvorfor andre anser det for en uorganisk og ikke -organisk natur.
Kan tjene deg: dihydroxyacetone: struktur, egenskaper, innhenting, brukMolekylære interaksjoner
Av molekylet h2Co3 Det kan kommenteres at geometrien er trigonal flat, med karbonet som ligger i midten av trekanten. I to av sine hjørner har den OH -gruppene, som er hydrogenbro -givere; Og i den gjenværende andre, et oksygenatom i gruppe C = O, hydrogenbro akseptor.
Dermed h2Co3 Det har en sterk tendens til å samhandle med protiker eller oksygenerte løsningsmidler (og også nitrogen).
Og tilfeldigvis oppfyller vann disse to egenskapene, og affiniteten til h er slikt2Co3 for henne som nesten umiddelbart gir henne en h+ Og en hydrolysebalanse som involverer HCO -arter begynner å bli etablert3- og h3ENTEN+.
Det er grunnen til at bare tilstedeværelsen av vann dekomponerer kullsyre og gjør isolasjonen som ren forbindelse for komplisert.
Ren kullsyre
Tilbake til H -molekylet2Co3, Ikke bare er den flat, i stand til å etablere hydrogenbroer, men det kan også presentere Cis-Trans isomeía; Dette er, på bildet vi har cis -isomeren, med de to H som peker i samme retning, mens de i trans -isomeren ville peke i motsatte retninger.
Cis -isomeren er den mest stabile av begge deler, og det er derfor den er den eneste som vanligvis er representert.
Et rent faststoff av h2Co3 Den består av en krystallinsk struktur sammensatt av lag eller molekyler blader som samhandler med sidens hydrogenbroer. Dette forventes, å være molekylet h2Co3 Flat og trekantet. Når sublimal, vises sykliske twilights (h2Co3)2, som er forbundet med to hydrogenbroer c = o - oh.
Symmetrien til HR2Co3 Det har ikke vært i stand til å defineres av øyeblikkene. Det ble ansett for å krystallisert som to polymorfer: α-H2Co3 og β- h2Co3. Imidlertid α-H2Co3, syntetisert basert på en blanding av CHO3COOH-CO2, Det ble demonstrert at det faktisk var Cho3OROH: En monometri kullsyre Ster.
Egenskaper
Det ble nevnt at h2Co3 Det er en diprotsyre, slik at du kan donere to H -ioner+ til et medium som aksepterer dem. Når dette mediet er vann, er ligningene av dets dissosiasjon eller hydrolyse:
H2Co3(AC) + H2Eller (l) HCO3-(AC) + H3ENTEN+(AC) (Ka1 = 2,5 × 10−4)
HCO3-(AC) + H2Eller (l) co32-(AC) + H3ENTEN+(AC) (Ka2 = 4,69 × 10−11)
HCO3- Det er bikarbonatet eller hydrogenokarbonatanionen, og CO32- Karbonatanionen. De indikerer også sine respektive likevektskonstanter, Ka1 og ka2. Å være ka2 Fem millioner ganger mindre enn KA1, Dannelsen og konsentrasjonen av CO32- De er foraktelige.
Så selv om det er en diprotsyre, den andre H+ Du kan knapt frigjøre det betydelig. Imidlertid tilstedeværelsen av CO2 oppløst i store mengder nok til å forsurte mediet; I dette tilfellet vann, og senker pH -verdiene (under 7).
Kan tjene deg: fusjonÅ snakke om kullsyre refererer praktisk talt til en vandig løsning der HCO -arter dominerer3- og h3ENTEN+; Det kan ikke isoleres ved konvensjonelle metoder, siden de minste forsøkene vil fortrenge løselighetsbalansen i CO2 til dannelsen av bobler som ville rømme fra vann.
Syntese
Oppløsning
Kullsyre er en av de enkleste forbindelsene å syntetisere. Som? Den enkleste metoden er å boble, ved hjelp av et sugerør eller sorbet, luften som vi puster ut i et volum vann. Fordi vi puster ut i Essence Co2, Denne boblen i vannet, og løfter opp en liten brøkdel av det samme.
Når vi gjør dette, oppstår følgende reaksjon:
Co2(g) + h2Eller (l) h2Co3(AC)
Men på sin side må løseligheten til CO vurderes2 i vann:
Co2(g) CO2(AC)
Begge co2 som h2Eller er uorganiske molekyler, så h2Co3 Det er uorganisk siden dette poenget sett.
Væskedampbalanse
Som et resultat har vi et system i likevekt som avhenger veldig av delvis trykk fra CO2, så vel som væsketemperatur.
For eksempel, hvis presset fra CO2 Det øker (i tilfelle vi blåser i luften med mer kraft gjennom sorbet), vil det danne mer H2Co3 og pH vil bli surere; Siden beveger den første balansen seg til høyre.
På den annen side, hvis vi varmer opp oppløsningen av h2Co3, Løseligheten av CO vil avta2 I vannet fordi det er en gass, og balansen vil deretter bevege seg til venstre (det vil være mindre h2Co3). Lignende vil være hvis vi prøver å bruke et vakuum: CO2 Den vil rømme så vel som vannmolekylene, som vil flytte balansen til venstre igjen.
Rent faststoff
Ovennevnte gjør det mulig å komme til en konklusjon: fra en løsning av h2Co3 Det er ingen måte å syntetisere denne syren som et rent fast stoff gjennom en konvensjonell metode. Imidlertid er det gjort, siden 90 -tallet av forrige århundre, med start fra faste blandinger av CO2 og h2ENTEN.
Til denne solide blandingen CO2-H2Eller ved 50% blir det bombardert med protoner (en type kosmisk stråling), slik at ingen av de to komponentene vil slippe unna og dannelsen av H oppstår2Co3. For dette formålet har en Cho -blanding også blitt brukt3Oh-co2 (Husk α-H2Co3).
En annen metode er å gjøre det samme, men direkte ved hjelp av tørris, ikke noe mer.
Av de tre metodene kan NASAs forskere komme.
Kan tjene deg: Volumetrisk pipette: Kjennetegn, bruk, kalibrering og feilapplikasjoner
Kullsyre i seg selv er en forbindelse uten noe verktøy. Av løsningene kan du imidlertid utarbeide dempeløsninger basert på HCO -jevnaldrende3-/Co32- eller h2Co3/HCO3-.
Takk til disse løsningene og virkningen av den karboniske anhydraseenzymet, til stede i de røde blodlegemene, CO2 Produsert i pusting kan transporteres i blodet til lungene, hvor det endelig frigjøres for å bli utpustet utenfor kroppen vår.
Bubjueo av co2 Det drar nytte av å gassutvikle den hyggelige og karakteristiske følelsen som de etterlater seg i halsen når de drikker dem.
Også tilstedeværelsen av h2Co3 Det har geologisk betydning i dannelsen av kalksteinstalaktitter, da det løser dem sakte til de stammer fra deres spisse finish.
Og på den annen side kan løsningene deres brukes til å fremstille noen metallbikarbonater; Selv om det er mer lønnsomt og enkelt å bruke et bikarbonatsalt (Nahco3, For eksempel).
Risiko
Kullsyre har så veldig lite liv under normale forhold (de anslår at rundt 300 nanosekunder), som praktisk talt er ufarlig for miljøet og levende vesener. Som nevnt før, innebærer det imidlertid ikke at det ikke kan generere en bekymringsfull endring i pH i havvannet, noe som påvirker marin fauna.
På den annen side er den sanne "risikoen" i det forgassede vanninntaket, siden mengden CO2 Oppløst i dem er mye større enn i normalt vann. Imidlertid, og igjen, er det ingen studier som har vist at drikking av forgasifisert vann representerer en dødelig risiko; Hvis du til og med anbefaler det å faste og bekjempe fordøyelsesbesvær.
Den eneste negative effekten som er observert på de som drikker dette vannet, er følelsen av fylde, siden magen er fylt med gasser. Av dette (for ikke å nevne brus, siden de er sammensatt av mye mer enn bare kullsyre), kan det sies at denne forbindelsen ikke er giftig i det hele tatt.
Referanser
- Dag, r., & Underwood, a. (1989). Kvantitativ analytisk kjemi (Fifth ed.). Pearson Prentice Hall.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Kullsyre. Hentet fra: i.Wikipedia.org
- Danielle Reid. (2019). Kullsyre: Formasjon, struktur og kjemisk ligningsvideo. Studere. Gjenopprettet fra: Studie.com
- Götz Bucher & Wolfram Sander. (2014). Avklaring av strukturen til kullsyre. Vol. 346, utgave 6209, s. 544-545. Doi: 10.1126/vitenskap.1260117
- Lynn Yarris. (22. oktober 2014). Ny innsikt i kullsyre i vann. Berkeley Lab. Gjenopprettet fra: NewsCenter.lbl.Gov
- Claudia Hammond. (14. september 2015). Er glitrende vann veldig dårlig for deg? Hentet fra: BBC.com
- Jürgen Bernard. (2014). Fast og gassformig kullsyre. Institute of Physical Chemistry. University of Innsbruck.
- « Varmeoverføringslover, overføringsformer, eksempler
- 15 fordeler med epler for fysisk og mental helse »

