Píchrons acid hva er, struktur, syntese, egenskaper
- 4089
- 201
- Oliver Christiansen
Han Píchronsyre Det er en sterkt nitrado organisk kjemisk forbindelse hvis navn iupac er 2,4,6-trinitrofenol. Den molekylære formelen er C6H2(NEI2)3Åh. Det er en veldig sur fenol, og kan bli funnet som natriumpikrat, ammonium eller kalium; det vil si i sin ioniske form C6H2(NEI2)3PÅ EN.
Det er et fast stoff av en sterk smak av bitter, og derfra henter navnet sitt, fra det greske ordet 'Prikos', som betyr bitter. Det er funnet som våte gule krystaller. Dens uttørking eller dehydrering er farlig, siden det øker de ustabile egenskapene som gjør det eksplosivt.
Píchronsyre brukes som grunnlag for syntese av permanente gule tonefargestoffer. Noen patologer og forskere bruker det i fiksering eller farging av vevsseksjoner og andre immunhistokjemiske prosesser.
Det er veldig nyttig i utviklingen av farmasøytiske produkter. I tillegg brukes det i utdyping av kamper eller kamper og eksplosiver. Det brukes også til å registrere metaller, for å lage farget glass og i den kolorimetriske bestemmelsen av biologiske parametere som kreatinin.
Struktur
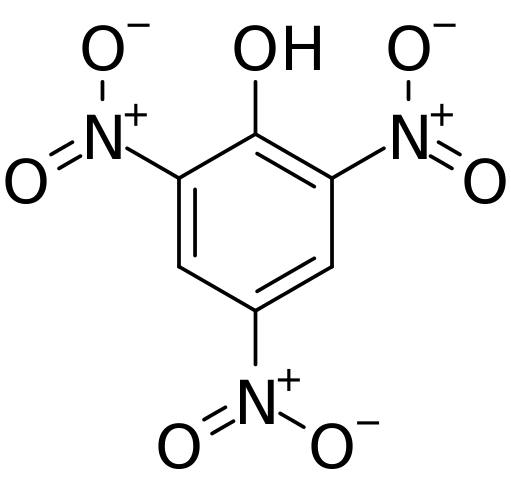
 Struktur og formell belastning i pychorinsyre. Kilde: CVF-PS [Public Domain]
Struktur og formell belastning i pychorinsyre. Kilde: CVF-PS [Public Domain] I det øvre bildet vises alle bindinger og strukturen i seg selv av píchronscyremolekylet mer detaljert. Den består av en fenol med tre nitro substituenter.
Det kan sees at i grupper ikke2 Nitrogenatom har en positiv delvis belastning, og derfor etterspørsel etter elektronisk tetthet fra omgivelsene. Men den aromatiske ringen tiltrekker seg også elektronene mot seg selv, og før de tre nei2 ender opp med å gi en del av sin egen elektroniske tetthet.
Som en konsekvens av dette, har OH -gruppen oksygen en tendens til å dele en av sine gratis elektroniske jevnaldrende for å levere den elektroniske mangelen som ringen har lidd; Og ved å gjøre det, dannes lenken C = O+-H. Denne positive delvise belastningen i oksygen svekker O-H-bindingen, og surhet øker; det vil si at det vil bli frigitt som hydrogenion, h+.
Syre fenol
Det er av denne grunn at denne forbindelsen er en usedvanlig sterk syre (og reagens), enda mer enn eddiksyre i seg selv. Imidlertid er forbindelsen virkelig en fenol hvis surhet overgår den av de andre fenolene; på grunn, som nettopp nevnt, ikke substituentene2.
Kan tjene deg: Termodynamiske prosesserDerfor, siden det er en fenol, har OH -gruppen prioritet og leder oppregningen i strukturen. De tre nei2 De er lokalisert i karbonatomer 2, 4 og 6 i den aromatiske ringen med hensyn til OH. Herfra stammer IUPAC-nomenklaturen for denne forbindelsen: 2,4,6-trinitrofenol (TNP).
Hvis gruppene ikke var det2, Eller hvis det var et mindre antall av dem i ringen, ville O-H-koblingen svekket seg mindre, og derfor ville forbindelsen ha mindre surhet.
Krystallinsk struktur
Pycric acid -molekyler bestilles på en slik måte at de favoriserer sine intermolekylære interaksjoner; enten for dannelse av hydrogenbroer mellom OH -grupper og ikke2, Dipolo-dipolo-krefter, eller elektrostatiske frastøtninger mellom de dårlige elektronregionene.
Det kan forventes at grupper ikke gjør det2 De frastøter hverandre og veiledning i retning av nærliggende aromatiske ringer. På samme måte kunne ikke ringene justere en oppå hverandre på grunn av en økning i elektrostatisk frastøtninger.
Som et resultat av alle disse interaksjonene, klarer Píchric Acid å danne et tredimensjonalt nettverk som definerer en krystall; hvis enhetlige celle tilsvarer et krystallinsk system av den ortorrombiske typen.
Syntese
Opprinnelig ble den syntetisert fra naturlige forbindelser som dyrehornderivater, naturlige harpikser, blant andre. Fra 1841 har fenol blitt brukt som en forløper for pikrinsyren, etter flere ruter eller gjennom flere kjemiske prosedyrer.
Som allerede sagt, er det en av de surere fenolene. For å syntetisere det kreves det først at fenolen lider av en sulfoneringsprosess, etterfulgt av en nitreringsprosedyre.
Sulfoneringen av den vannfrie fenol utføres når du behandler fenol med røyksvovelsyre, forekommer aromatiske elektrofyliske substitusjoner av H av sulfonatgrupper, så så3H, i stillingen -orto og -para med hensyn til OH -gruppen.
Dette produktet, 2,4-pynoldisulfonsyre, nitreringsprosessen utføres, og behandler det med konsentrert salpetersyre. Ved å gjøre det, de to så gruppene3H erstattes av nitrogrupper, nei2, Og en tredje kommer inn i den andre nitroposisjonen. Følgende kjemiske ligning illustrerer dette:
Kan tjene deg: elastiske materialer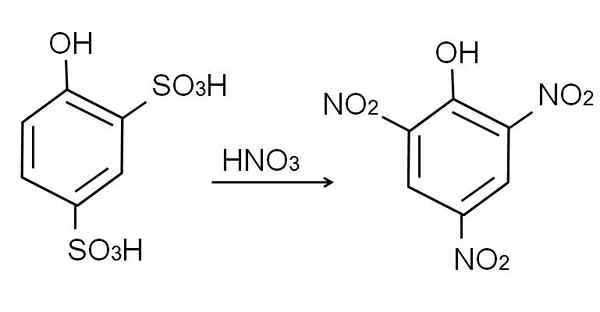 Syre nitrering 2,4-fenoldisulfonisk. Kilde: Gabriel Bolívar.
Syre nitrering 2,4-fenoldisulfonisk. Kilde: Gabriel Bolívar. Direkte nitrering av fenol
Nitreringsprosessen til fenol kan ikke utføres direkte, siden mål med høy molekylvekt genereres. Denne syntesemetoden trenger en veldig nøye kontroll av temperaturen siden den er veldig eksoterm:
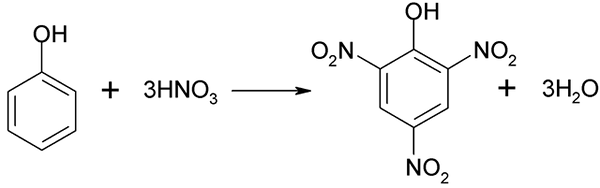 Direkte nitrering av fenol. Kilde: Akane700 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Direkte nitrering av fenol. Kilde: Akane700 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Piekrinsyre kan oppnås ved utførelse av den direkte nitreringsprosessen på 2,4-dinitrofenol, med salpetersyre.
En annen form for syntese er å behandle benzen med salpetersyre og kvikksølvnitrat.
Fysiske og kjemiske egenskaper
Molekylær vekt
229.104 g/mol.
Fysisk utseende
Gul masse våte krystaller.
Lukt
Det er toalett.
Smak
Det er veldig bittert.
Smeltepunkt
122.5 ° C.
Kokepunkt
300 ° C. Men når du smelter, eksploderer det.
Tetthet
1,77 g/ml.
Løselighet
Det er en moderat vannløselig forbindelse. Dette er fordi OH -gruppene dine og ikke2 De kan samhandle med vannmolekyler med hydrogenbroer; Selv om den aromatiske ringen er hydrofob, og det er derfor den skader løseligheten.
Korrosivitet
Pycric acid er etsende generelt for metaller, bortsett fra tinn og aluminium.
Pka
0,38. Det er en sterk organisk syre.
Ustabilitet
Píchronsyre er preget av å ha ustabile egenskaper. Det utgjør en risiko for miljøet, det er ustabilt, eksplosivt og giftig.
Den må lagres godt lukket for å unngå dehydrering, siden pikrinsyren er veldig eksplosiv hvis den har lov til å tørke. Du må være veldig forsiktig med dens vannfri form, fordi den er veldig følsom for friksjon, slag og varme.
Pychral syre skal lagres i ventilerte, friske steder, langt fra oksidable materialer. Det er irriterende å kontakte med huden og slimhinnene, den skal ikke inntatt, og den er giftig for kroppen.
applikasjoner
Píchrinsyre har blitt mye brukt i forskningsområdet, innen kjemi, i industrien og på militærfeltet.
Etterforskning
Når den brukes som celle- og vevsfiksativ, forbedrer det fargestillingen av deres med syrefargestoffer. Det skjer med trikromiske fargeleggingsmetoder. Etter å ha satt stoffet med Formaline, anbefales en ny fiksering med píchronsyre.
Kan tjene deg: trykk filter: egenskaper, deler, hvordan det fungerer, brukerPå denne måten er en intens og veldig lys farge på vevene garantert. Gode resultater oppnås med grunnleggende fargestoffer. Forholdsregler må imidlertid.
Organisk kjemi
-I organisk kjemi brukes det som alkaliske picrates for å gjøre identifisering og analyse av forskjellige stoffer.
-Brukes i metallanalytisk kjemi.
-I kliniske laboratorier brukes det til å bestemme serum og urinivå av kreatinin.
-Det har også blitt brukt i noen av reagensene som ble brukt til analyse av glukosenivåer.
I bransjen
-På nivå med fotografisk industri har pkrinsyre blitt brukt som en sensibilisator i fotografiske emulsjoner. Har vært en del av utdypingen av produkter som plantevernmidler, sterke insektmidler, blant andre.
-Píchronsyre brukes til å syntetisere andre mellomliggende kjemiske forbindelser som kloropikrin og pikramisk syre, for eksempel. Fra disse forbindelsene er det utviklet noen medisiner og fargestoffer for skinnindustrien.
-Piekrinsyre ble brukt i behandlingen av brannskader, for eksempel antiseptisk og andre forhold, før dets toksisitet ble bevist.
-Viktig komponent av den eksplosive naturen i utdyping av kamper og batterier.
Militære søknader
-På grunn av den høye eksplosiviteten til pkronsyre, har den blitt brukt i militære våpen ammunisjonsanlegg.
-Píchrric acid presset og støpt i artilleriprosjektiler, pumper og gruver har blitt brukt.
-Pycric acid ammoniumsalt har blitt brukt som et eksplosivt, er veldig kraftig, men mindre stabilitet enn TNT. For en tid ble det brukt som en rakettdrivende komponent.
Toksisitet
Det er bevist at det er veldig giftig for den menneskelige organismen og generelt for alle levende vesener.
Det anbefales å unngå innånding og inntak, for å ha akutt oral toksisitet. Det forårsaker også mutasjon i mikroorganismer. Det gir giftige effekter på dyrelivet, hos pattedyr og generelt i miljøet.
Referanser
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Purdue University. (2004). Pikrinsyreeksplosjon. Hentet fra: Chemed.Chem.Purdue.Edu
- « Patricia Benner -biografi, teori og andre bidrag
- Maguey hva er, egenskaper, habitat, reproduksjon »

