Cysteinegenskaper, struktur, funksjoner, biosyntese
- 1364
- 369
- Prof. Theodor Gran
De Cystein (Cys, c) er en av de 22 aminosyrene som er funnet i naturen som en del av polypeptidkjedene som utgjør proteiner fra levende vesener. Det er viktig for stabiliteten i de tertiære strukturene av proteiner, da det hjelper dannelsen av intramolekylære disulfidbroer.
I tillegg til det er sant for andre aminosyrer som alanin, arginin, asparagin, glutamat og glutamin, glycin, prolin, serin og tyrosin, er mennesker i stand til å syntetisere cystein, så dette anses ikke som en essensiell aminosyre.
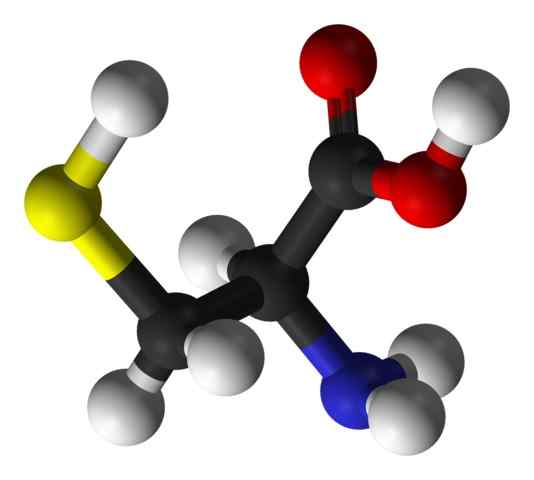
 Cystein aminosyrestruktur (kilde: Hattrich [offentlig domene] via Wikimedia Commons)
Cystein aminosyrestruktur (kilde: Hattrich [offentlig domene] via Wikimedia Commons) Til tross for dette, og med tanke på at syntesehastigheter ikke alltid leverer kroppskrav, beskriver noen forfattere cystein som en "betinget" i det vesentlige "aminosyre.
Denne aminosyren ble navngitt av "cystina", en komponent i de vesikulære beregningene som ble oppdaget i 1810, hvis navn ble myntet i 1832 av en. Baudrimont og f. Malaguti. Noen år senere, i 1884, og. Baumann oppdaget at cystein var et produkt av cystinreduksjon.
Etter arbeidet utført av Bauman, i 1899, ble det bestemt at cystein er hovedbestanddelen av proteinet som danner hornene til forskjellige dyr, som antydet dets mulige bruk for polypeptidsyntese.
For tiden er det kjent at kroppscystein kommer fra mat, proteingjenvinning og endogen syntese, som hovedsakelig skjer i hepatocytter.
[TOC]
Kjennetegn
Cystein har en molekylvekt på 121.16 g/mol og finnes sammen med leucin, isoleucin, valin, fenylalanin, tryptofan, metionin og tyrosin, blant de mest hydrofobe aminosyrene.
Det tilhører gruppen av polare aminosyrer uten belastning, og i likhet med andre aminosyrer kan den nedbrytes ved alkalisk hydrolyse ved høye temperaturer.
Som tryptofan, serin, glycin og treonin, er cystein en metabolsk forløper for glukoneogenese og ketogenese (dannelse av ketonlegemer).
Denne aminosyren eksisterer som en del av peptidsekvensen av proteiner, men kan også være fri i blodplasma som homogene disulfider (cystin, et derivat) eller blandet, sammensatt av homocystein-cysteinform.
Hovedforskjellen mellom fri cystein og den som finnes i proteinstrukturen er at den første er i en veldig rusten redokstilstand, mens den siste vanligvis er ganske redusert.
Struktur
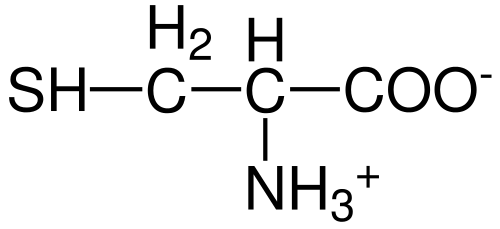
Som med resten av aminosyrene beskrevet til dags dato, har cystein et sentralt karbonatom, som er chiral og er kjent som karbon α.
Fire forskjellige kjemiske arter er forbundet med dette karbonatom:
- En aminogruppe (-NH3+)
- En karboksylgruppe (-co-)
- et hydrogenatom og
- En substituent (-r).
Substituentgruppen er den som gir identitet til hver aminosyre, og cystein er preget av å inneholde et svovelatom som en del av en gruppe Tiol enten Sulfhydrillo (-Ch2-sh).

Det er denne gruppen som lar den delta i dannelsen av intra-intermolekylære disulfidbroer. Siden det er en nukleofil, kan du også delta i substitusjonsreaksjoner.
Faktisk kan denne sidekjeden av cystein modifiseres for dannelse av to forbindelser kjent som "selenocystein" og "lantionine". Den første er en aminosyre som også deltar i proteindannelse, og den andre er et ikke -protein aminosyrededat.
Kan tjene deg: Histoner: Kjennetegn, struktur, typer og funksjonerCystein Tiol -gruppen er også preget av sin store affinitet til sølv- og kvikksølvioner (Ag+ og Hg2+).
Funksjoner
Hovedfunksjonene til cystein i levende organismer har å gjøre med deres deltakelse i proteindannelse. Spesielt deltar Cystein i etablering av disulfidbroer, som er avgjørende for dannelse av tertiær proteinstruktur.
I tillegg er denne aminosyren ikke bare nyttig for proteinsyntese, men deltar også i syntesen av glutathione (GSH) og gir redusert svovel for metionin, lipoinsyre, tiamin, koenzym A (COA), molybdopterin (en kofaktor) og annen Forbindelser med biologisk betydning.
Under forhold med overdreven mengde svoveliserte aminosyrer, kan cystein og andre relaterte aminosyrer brukes til produksjon av uorganisk pyruvat og svovel. Pyruvate klarer å bli omdirigert mot den glukoneogene ruten, og serverer for glukoseproduksjon.
Keratinene, som er en av de mest tallrike typene strukturelle proteiner i dyreriket, er rike på cysteinrester. For eksempel inneholder saueull mer enn 4% svovel fra denne aminosyren.
Cystein deltar også i mange oksydreduksjonsreaksjoner, så det er en del av det aktive stedet for noen enzymer.
Når du reagerer med glukose, genererer denne aminosyren reaksjonsprodukter som introduserer attraktive smak og aromaer til noen kulinariske preparater.
Biosyntese
Biosyntesen av aminosyrer i menneskekroppen og hos andre dyr (pattedyr og ikke-pattedyr) foregår i en vevsform og celleklasse; Det er en prosess som fortjener energi og vanligvis skilles mellom forskjellige organer.
Leveren er et av hovedorganene som er involvert i syntesen av mest ikke -essensielle aminosyrer, uavhengig av arten som er vurdert.
I dette syntetiseres ikke bare cystein, men også aspartat, asparagin, glutamat og glutamin, glycin, serin, tyrosin og andre fra dets spesifikke aminosyreforløpere.
I 1935 bestemte Erwin -merket at cystein, hos pattedyr, er naturlig syntetisert fra metionin, som utelukkende finner sted i levervev.
Denne prosessen kan oppstå på grunn av en "transmetil" av metionin, der metylgrupper overføres til bakke og kreatin. Imidlertid kan cystein også dannes fra metionin takket være en transulfurasjon.
Deretter ble det påvist at i tillegg til metionin, er noen syntetiske forbindelser som N-acetylcystein, cysteamin og cystamin, nyttige forløpere for cysteinsyntese.
Når det.
Syntesemekanisme
Mekanismen for syntese av cystein fra den mest kjente metodinen er den av trans -ululo. Dette skjer hovedsakelig i leveren, men det er også bestemt i tarmen og bukspyttkjertelen.
Dette skjer fra homocystein, en forbindelse avledet fra aminosyremetodin; Og den første reaksjonen av denne biosyntetiske ruten er en kondensasjon som er katalysert av ß-sentase (CBS) cistationine-enzymet (CBS).
Kan tjene deg: uracil: struktur, funksjoner, egenskaper, synteseDette enzymet representerer passering av "engasjement" av ruten og kondenserer en homocystein med en serinrest, en annen proteinaminosyre, som produserer cystasjonin. Deretter er denne forbindelsen "kuttet" eller "splittet" av cistationasa -enzymet, noe som fører til frigjøring av cystein.
Reguleringen av CBS enzymatisk aktivitet er mediert av tilgjengeligheten av metodin og av redokstilstanden til cellen der denne prosessen skjer.
Gjennom cysteinsyntese -ruten kan celler håndtere overflødig metodin, ettersom konvertering til cystein er en irreversibel prosess.
Cysteinsyntese i planter og mikroorganismer
I disse organismer syntetiseres cystein hovedsakelig fra uorganisk svovel, som er den mest tallrike kilden til brukbar svovel i den aerobe biosfæren.
Dette blir tatt, kommer inn i cellene og reduseres deretter til sulfid (S2-), som er inkorporert i cystein på en lignende måte som det som skjer med ammonium i syntesen av glutamat eller glutamin.
Metabolisme og nedbrytning
Katabolisme cystein forekommer hovedsakelig i leverceller (hepatocytter), selv om det også kan forekomme i andre typer celler som nevroner, endotelceller og glatte muskelceller i kroppsvaskulatur.
Visse feil i katabolismen av cystein produserer en arvelig sykdom kjent som "cystinuria", preget av tilstedeværelsen av cystinberegninger i nyrene, blæren og urinlederen.
Cystinen er en aminosyre avledet fra cystein og beregningene dannes ved forening av to molekyler gjennom svovelatomer.
En del av metabolismen av cystein resulterer i dannelse av vitenskapelig syre, hvorfra tyrefekting, en ikke-proteisk aminosyre dannes. Reaksjonen katalyseres av dioxigenasa cysteinenzym.
I tillegg kan cystein oksyderes av formaldehyden for å produsere n-formil cystein, hvis påfølgende prosessering kan føre til dannelse av "varer" (produkt av kondensering av cysteiner med aromatiske forbindelser).
Hos dyr brukes cystein også, så vel som glutamat og glutamin, for syntese av koenzym A, glutathione (GSH), pyruvat, sulfat og sulfiderisyre.
En av metodene for konvertering fra cystein til pyruvat skjer i to trinn: den første innebærer fjerning av svovelatom og den andre A -transamineringsreaksjonen.
Nyrene er ansvarlige for utskillelse av sulfater og sulfitter avledet fra metabolismen av svovelforbindelser som cystein, mens lunger pust ut svoveldioksid og sulfidronsyre.
Glutation
Glutathione, et molekyl dannet av tre aminosyreavfall (glycin, glutamat og cystein) er et molekyl som er til stede i planter, dyr og bakterier.
Den har spesielle egenskaper som gjør det til en utmerket redoks “buffer”, da den beskytter celler mot forskjellige typer oksidativt stress.
Mat rik på cystein
Cystein finnes naturlig i matvarer som inneholder svovel som eggeplommene (gult) av egg, rød paprika, hvitløk, løk, brokkoli, blomkål, kolliflower, kolliler og Brussel -choles, vannklokker og sennepsblader.
Det er også mest til stede i proteinrike matvarer som kjøtt, belgfrukter og meieriprodukter, blant dem:
Kan tjene deg: ovalbumin: struktur, funksjoner, denaturering- Kumkjøtt, svinekjøtt, kylling og fisk
- Havre og linser
- Solsikkefrø
- Yoghurt og ost
Fordelene med cysteininntak
Det anses at inntaket forhindrer håravfall og stimulerer veksten. I matindustrien brukes det veldig som et utsatt massasjemiddel og også for å "reprodusere" kjøttlignende smaker.
Andre forfattere har understreket at inntaket av kosttilskudd eller mat -rike matvarer reduseres.
Noen kosttilskudd relatert til cystein brukes av mennesker som antioksidanter, noe som anses som gunstig fra synspunktet om "forsinkelsen" av aldring.
N-acetylcystein (en forløper i syntesen av cystein) er for eksempel tatt som et ernæringstilskudd, siden dette resulterer i en økning i glutationbiosyntesen (GSH).
Relaterte sykdommer
Det er noen vitenskapelige publikasjoner som relaterer høye nivåer av plasma cystein med overvekt og andre relaterte patologier som hjerte- og karsykdommer og andre metabolske syndromer.
Cystinuria, som nevnt ovenfor, er en patologi som er relatert til tilstedeværelsen av cystinsstein, et glidelåsderivat, på grunn av en genetisk defekt i reabsorpsjonen av de dibasiske aminosyrene som cystin.
Mangelforstyrrelser
Cysteinmangel har vært relatert til oksidativt stress, siden dette er en av hovedforløperne for glutathione -syntese. Derfor kan mangler i denne aminosyren føre til for tidlig aldring og alle leilighetene som dette betyr.
Det har blitt demonstrert eksperimentelt at cysteintilskudd forbedrer funksjonene til skjelettmuskelen, reduserer forholdet mellom fett og ikke -fett kroppsmasse, reduserer plasmanivået av inflammatoriske cytokiner, forbedrer immunsystemets funksjoner, etc.
På midten av 1990 -tallet antydet noen studier at anskaffet immunsvikt (AIDS) syndrom kan være en konsekvens av et virusindusert cysteinmangel.
Disse uttalelsene ble støttet av det faktum at HI-positive pasienter som ble undersøkt hadde lave nivåer av plasma cystin og cystein, i tillegg til reduserte intracellulære konsentrasjoner av glutation.
Referanser
- Dröge, w. (1993). Cystein og glutathione-defikitet hos AIDS-pasienter: en begrunnelse for behandling med N-akisyl-cystein. Farmakologi, 46, 61-65.
- Dröge, w. (2005). Oksidativt stress og aldring: er aldring av et cysteinfiskhetssyndrom? Filosofiske transaksjoner av Royal Society B: Biologiske vitenskaper, 360(1464), 2355-2372.
- Elshorbagy, a. K., Smith, a. D., Kozich, v., & Refsum, h. (2011). Cystein og overvekt. Overvekt, tjue(3), 1-9.
- Kridich, n. (2013). Biosyntese av cystein. ECOSAL Plus, 1-30.
- McPherson, r. TIL., & Hardy, G. (2011). Kliniske og ernæringsmessige fordeler med cysteinanriket proteintilskudd. Nåværende mening i klinisk ernæring og metabolsk pleie, 14, 562-568.
- Mokhtari, v., Afsharian, s., Shahhoseini, m., Kalantar, s. M., & Moini, a. (2017). En gjennomgang av forskjellige bruksområder av n-acetylcystein. Cell Journal, 19(1), 11-17.
- PISTE, s. (2013). Cystein-master antioksidant. International Journal of Pharmaceutical, Chemical and Biological Sciences, 3(1), 143-149.
- Quig, d. (1998). Cysteinmetabolisme og metalltoksisitet. Alternativ medisinanmeldelse, 3(4), 262-270.
- Wu, g. (2013). Aminosyrer. Biokjemi og ernæring. Boca Raton, FL: Taylor & Francis Group.
- « Sosiale læringsegenskaper, Bandura -teori, eksempler
- Sosio -følelsesmessige utdanningsdimensjoner, betydning, førskole »

