Aluminiumklorid (ALCL3)

- 3799
- 1199
- Daniel Skuterud
 Formel og struktur av aluminiumklorid
Formel og struktur av aluminiumklorid Hva er aluminiumklorid?
Han aluminiumklorid Det er en uorganisk kjemisk forbindelse hvis formel er ALCL3. Det presenteres som et fast eller hvitt støv, selv om det på grunn av en forurensning med jernklorid og fuktighet, kan det bli gult. Den består av en Lewis -syre, men under visse omstendigheter oppfører den seg også som en Lewis -base.
Til tross for aluminium som metall i det periodiske bordet, er det et kovalent binding mellom aluminium og klor for å danne aluminiumklorid.
Dette kovalente bindingen kan forklare hvorfor smeltet aluminiumklorid er en dårlig leder av elektrisitet; Mens de smeltede saltene til andre forbindelser, for eksempel natriumklorid, er gode strømledere.
Aluminiumklorid produseres ved en eksoterm reaksjon mellom aluminium og klor, eller hydrogenklorid, ved en temperatur mellom 650 og 750 ºC.
Aluminiumklorid brukes som antitranspirant og for å bekjempe overdreven svette. Et av derivater brukes som et koagulerende middel i behandlingen av industrielt avløpsvann, og brukes også som hovedkatalysator i de kjemiske reaksjonene i industrien.
Aluminiumkloridstruktur
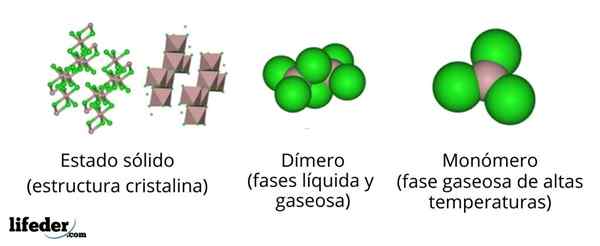
I det øvre bildet har vi forskjellige representasjoner for hver av de krystallinske eller molekylære strukturer som viser det vannfrie aluminiumklorid, ALCL3, I flere av hans fysiske tilstander.
ALCL3 Solid består av en monoklinisk krystallinsk struktur dannet av lag med octaedros koordinert med hverandre. I disse oktaedraene (brun farge), ionet til3+ Det er koordinert med seks CL -ioner-, Fungerende klorider som broer mellom to oktaedra.
Når temperaturen øker og Alll er grunnlagt3, Lagene er delt i enheter til2Cl6 (Bildesenter). Nå kobler aluminiumatomene seg med tre kloratomer og en kobling med det andre aluminiumatomet: CL3Al-alcl3. Disse dimerer forklarer hvorfor ALCL3 smeltet er mindre tett enn krystaller.
Kan tjene deg: Gadolinio: Struktur, egenskaper, innhenting, brukI dampfasen, dimerer til2Cl6 De distanserer hverandre. Men hvis denne dampen blir utsatt for høye temperaturer, dissosierer dimeren i molekylære enheter ALCL3, der aluminiumatom danner tre koblinger med kloratomer. ALCL3 presenterer en trigonal flat geometri.
Aluminiumkloridegenskaper
 Solid prøve av aluminiumklorid med gulaktige toner. Kilde: Xlollitox, CC av 3.0, via Wikimedia Commons
Solid prøve av aluminiumklorid med gulaktige toner. Kilde: Xlollitox, CC av 3.0, via Wikimedia Commons Formler
Alcl3 (vannfri)
Alcl3· 6H2O (heksahydrat)
Molmasse
133.34 g/mol (Anhydro)
241.43 g/mol (heksahydrat)
Fysisk utseende
Krystallinsk fast eller hvitt støv. Det kan bli en gulaktig fargetone på grunn av forurensning med jernklorid. Du kan også endre til en gråaktig farge for fuktighet.
Smeltepunkt
192.4 ºC
Kokepunkt
Sublima ved 178 ºC, så det er ikke lett å oppnå kokepunktet for aluminiumklorid.
Tetthet
2.48 g/cm3 (vannfri)
2.398 g/cm3 (Heksahydrat)
Vannløselighet
439 g/l a 0 ºC
458 g/l ved 20 ºC
466 g/l a 30 ºC
Aluminiumklorid er en hygroskopisk forbindelse som kan absorbere våt luftvann, og avgir en røyk under prosessen.
Løselighet i andre løsningsmidler
Etanoloppløselig, kloroform, karbontetraklorid, benzofenon og nitrobenzen. Litt løselig i benzen.
Damptrykk
1. 3.3 kPa ved 151 ºC (0.131 atm).
Goo
0.35 cp til 197 ºC
Reaktivitet
Aluminiumklorid er et amfotatstoff, det vil si at det oppfører seg som en syre eller en base. Imidlertid er virkningen som en syre overveiende, siden aluminiumklorid brukes som en Lewis -syre og samtidig er en katalysator i mange kjemiske reaksjoner; Blant dem, Friedel-Crafts reaksjon.
Kan tjene deg: neodym: struktur, egenskaper, brukSelv aluminiumklorid er klassifisert som en syre, i stedet for å gjøre det som et salt.
Vannlig aluminiumklorid i vandig oppløsning blir transformert til heksahydratsalt (ALCL3· 6H2O), som ikke kommer tilbake til den vannfrie formen ved oppvarming.
Aluminiumatomer av to ALCL -molekyler3 De samhandler med hverandre for å fullføre 8 elektroner i valenslaget, noe som resulterer i dannelsen av dimeren til2Cl6. Denne dimeren er til stede i smeltet aluminiumklorid og damp.
Aluminiumklorid reagerer med natriumhydroksyd for å danne aluminiumhydroksyd, et gelatinøst bunnfall:
Alcl3 + NaOH → Al (OH)3 + 3 NaCl
Aluminiumkloridapplikasjoner
Antitranspirant og antihemorragisk
 Aluminiumklorid er en del av ingrediensene som brukes i formuleringene av flere deodoranter. Kilde: TH145, CC BY-SA 2.0, via Wikimedia Commons
Aluminiumklorid er en del av ingrediensene som brukes i formuleringene av flere deodoranter. Kilde: TH145, CC BY-SA 2.0, via Wikimedia Commons Aluminiumklorid brukes som antitranspirant i personlige deodoranter, og brukes også til å kontrollere overdreven svette (hyperhidrose). Det brukes også i formuleringer for å kontrollere liten blødning, for eksempel de som presenteres i tannbehandlinger.
Kloakkbehandling
Aluminiumklorid i form av PAC (polyaluminklorid), brukes som koagulant i behandlingen av industrielt avløpsvann, på grunn av dens evne til å avklare vann og dehydrat slam.
Katalysator
Aluminiumklorid er en av de viktigste katalysatorene som brukes i bransjen, og fungerer som en katalysator i mange reaksjoner, inkludert Friedel-Crafts.
Kan tjene deg: Europium: Struktur, egenskaper, innhenting, brukAluminiumklorid katalyserer preparatreaksjonene til antraquinoner, hvorav noen brukes i tekstilindustrien. Det er også antraquinoner som har antibakterielle, antiparasittiske, soppdrepende og antivirale egenskaper.
Aluminiumklorid katalyserer reaksjonene produsert av dodecilbenzen, brukt i produksjon av vaskemidler og etylbenzen, forbindelse som ble brukt i fremstilling av polystyren, polymer brukt i utdyping av plast, harpikser og gummi.
Aluminiumklorid brukes også som en katalysator i en reaksjon som er en del av høy oktan bensinproduksjon. På samme måte katalyserer oljesprekkerprosessen.
Risiko
Aluminiumklorid er et etsende stoff, og kontakten kan forårsake irritasjon og hud- og øyeskader, noe som gir øyeskader.
Ved oppløsning i vannet kan giftige gasser frigjøres, for eksempel hydrogenklorid; Gasser som er i stand til å inhalere en irritasjon av nesen og halsen, og kunne forårsake tøff og lungeirritasjon. Denne irritasjonen kan føre til akkumulering av væske i lungene (lungeødem), som ender i en medisinsk nødsituasjon.
Det har prøvd å etablere en sammenheng mellom Alzheimers sykdom og aluminiumklorid; Selv om forskningsresultatene ikke er avgjørende.
På samme måte er forbindelsen mellom bruk av deodoranter som de bruker som anti -transpirant til ALLL blitt undersøkt3 og brystkreft. Forskning har ikke vært i stand til å demonstrere et avgjørende forhold. I alle fall blokkerer aluminiumklorid driften av et naturlig avgiftningssystem for organismen og varmeutslipp, for eksempel svette.
Referanser
- Wikipedia. (2021). Klorid aluminium. Hentet fra: i.Wikipedia.org
- National Center for Biotechnology Information (2021). Klorid aluminium, Pubchem Compound Sammendrag for CID 24012. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- NJ Health. (2008). FARLIG SUSTIANS Faktaark: Aluminiumklorid. [PDF]. Gjenopprettet fra: NJ.Gov
- Britannica Encyclopaedia. (2021). Klorid aluminium. Gjenopprettet fra: Britannica.com
- Elsevier f.V. (2021). Anthraquinones. Scientedirect. Hentet fra: Scientedirect.com
- John p. Cunha. (2. mai 2020). Topisk klorid aluminium. Gjenopprettet fra: rxlist.com

