Strontiumklorid (SRCL2)
- 1807
- 454
- Thomas Karlsen
Hva er strontiumklorid?
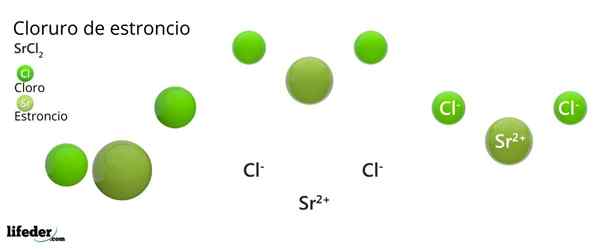
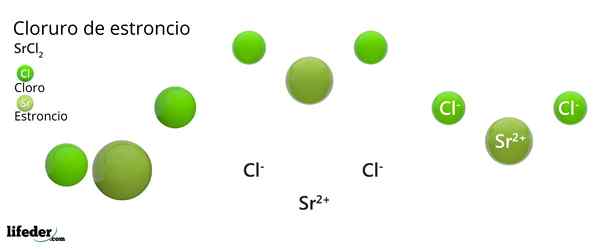
Han Strontiumklorid Det er en uorganisk forbindelse dannet av Strontium, alkalinoterreo metall (SR. Becamgbara) og klorhalogen. Fordi begge elementene har veldig forskjellige elektronegativiteter, er forbindelsen et ionisk faststoff hvis kjemiske formel er SRCL2.
Som et ionisk faststoff, består det av ioner. I tilfelle av SRCL2, De er en SR -kation2+ For hver annen anion CL-. Egenskapene og applikasjonene ligner på kalsium og bariumklorid.
Som kalsiumklorid (CACL2), er hygroskopisk og dets krystaller absorberer vann for å danne heksahydratsalt, der seks vannmolekyler er til stede i det krystallinske gitteret (SRCL2· 6H2ENTEN). Faktisk er tilgjengeligheten av hydratet større enn SRCL2 vannfri (uten vann).
En av hovedapplikasjonene er som en forløper for andre strontiumforbindelser; det vil si at det utgjør kilden til strontium i viss kjemisk syntese.
Kjemisk struktur av strontiumklorid
 Krystallinsk struktur av strontiumklorid
Krystallinsk struktur av strontiumklorid Det overordnede bildet representerer den krystallinske strukturtypen deformert av SRCL2 vannfri. I dette tilsvarer små grønne kuler SR -ioner2+, Mens de omfangsrike grønne kulene representerer CL -ionene-.
I denne strukturen hver SR -ion2+ Det er "fengslet" av åtte CL -ioner-, Følgelig å ha et koordinasjonsnummer lik 8 og muligens en kubisk geometri rundt seg. Det vil si at fire grønne sfærer lager taket på kuben, mens de fire andre gulvet, som ligger SR2+ I sentrum av det.
Hva ville være brusfasestrukturen? Lewis struktur for dette saltet er CL-SR-CL, tilsynelatende lineær og antar hundre prosent av koblingene. Imidlertid, i en gassfase -SRCL2(g)- Denne "linjen" viser en vinkel på omtrent 130 °, og er faktisk en slags V.
Kan tjene deg: Gassformstilstand: Kjennetegn, generell lov, eksemplerDenne anomalien kunne ikke forklares vellykket, med tanke på at Strontium ikke har delt elektroner som opptar elektronisk volum. Kanskje det kan være forårsaket av deltakelse av en orbital d i koblingene, eller til en kjerneelektronforstyrrelse.
Bruker/applikasjoner av strontiumklorid
Srcl2· 6H2Eller det har blitt brukt som tilsetningsstoff i organiske polymerer; For eksempel i polyvinylalkohol, for å endre dens mekaniske og elektriske egenskaper.
Det brukes som en strontiumferritt i fremstilling av keramiske og glassmagneter som er bestemt til å lage TV -frontkrystall.
Reagerer med natriumkromat (Na2CRO4) for å produsere strontiumkromat (SRCRO4), som brukes som korrosjonsbestandig maling for aluminium.
Når de blir oppvarmet med ild, lyser strontiumforbindelser med en rødlig flamme, og det er derfor de er bestemt til utdyping av fakler og fyrverkeri.
Medisinske applikasjoner
Radioisotopen av Strontium -klorid 89 (den mest tallrike isotopen er 85MR.
Bruk av fortynnede løsninger (3-5 %) i mer enn to uker i behandlingen av allergisk rhinitt (kronisk betennelse i nasal slimhinne), viser forbedringer i reduserende nysing og nasal gnidning.
Når den ble brukt i formuleringer av tannpasta for å redusere tannfølsomhet, danner en barriere på dentinalmikrotubuli.
Studier av denne forbindelsen viser en terapeutisk effekt sammenlignet med prednisolon (prednison medikamentmetabolitt) i behandlingen av ulcerøs kolitt.
Det kan tjene deg: molar fraksjon: hvordan det beregnes, eksempler, øvelserResultatene er basert på modellen til rottene; Likevel representerer det håp for de pasientene som også lider av osteoporose, siden de kan gå til samme medisin for å bekjempe de to sykdommene.
Det brukes til å syntetisere strontiumsulfat (SRSO4), enda mer tettere enn SRCL2. Imidlertid gjør den minimale vannløseligheten ikke den lett nok til å bli brukt i radiologi, i motsetning til bariumsulfat (Baso4).
Forberedelse av strontiumklorid
Strontiumklorid kan fremstilles ved direkte virkning av saltsyre (HCl) på rent metall, og forekommer dermed en redoks -reaksjon:
MR (S) + HCl (AC) => SRCL2(AC) + H2(g)
Her oksideres strontiummetallet ved å donere to elektroner for å tillate dannelse av gasshydrogen.
Også hydroksyd og strontiumkarbonat (SR (OH)2 og SRCO3) reagere med denne syren ved å syntetisere den:
Sr (OH)2(S) + 2HCl (AC) => SRCL2(AC) + 2H2Eller (l)
SRCO3(S) + 2HCl (AC) => SRCL2(AC) + CO2(g) + h2Eller (l)
Bruke krystalliseringsteknikker, oppnås SRCL2· 6H2ENTEN. Etter dehydrert ved termisk handling til SRCL endelig produserer2 vannfri.
Strontiumkloridegenskaper
De fysiske og kjemiske egenskapene til denne forbindelsen avhenger av om den er i den hydrede eller vannfrie formen. Dette er fordi elektrostatiske interaksjoner endres når vannmolekyler tilsettes den krystallinske gitteret til SRCL2.
Vannfri
Strontiumklorid er et hvitt krystallinsk fast stoff, med en molekylvekt på 158,53 g/mol, og en tetthet på 3,05 g/ml.
Smeltepunktene (874 ºC) og kokende (1250 ºC) er høye, noe som indikerer de sterke elektrostatiske interaksjonene mellom SR -ionene2+ og cl-. Det gjenspeiler også den store krystallinske retikulære energien som dens vannfrie struktur har.
Kan tjene deg: celluloseacetatSRCL -formasjon entalpi2 Fast er 828,85 kJ/mol. Dette refererer til den termiske energien som frigjøres av hver føflekk som er dannet fra komponentene i sine standardtilstander: klor og fast gass for strontium.
Heksahydrat
I form av heksahydrat har den en høyere molekylvekt enn dens vannfrie (267 g/mol) form, og en lavere tetthet (1,96 g/ml). Denne reduksjonen i dens tetthet skyldes at vannmolekylene "utvider" krystallene, og øker volumet; Derfor reduseres tettheten av strukturen.
Det er nesten to ganger tett enn vann ved romtemperatur. Vannløseligheten er veldig høy, men i etanol er den litt løselig. Dette skyldes dens organiske karakter til tross for dens polaritet. Det vil si at heksahydrat er en uorganisk polar forbindelse. Til slutt, ved 150 ºC, blir det dehydrert å produsere vannfri salt:
Srcl2· 6H2Eller (er) => srcl2(S) + 6H2O (g)
Referanser
- Wikipedia. (2018). Strontiumklorid. Innhentet fra.Wikipedia.org
- DrugBank. (2018). Strontium Chloride SR-89. DrugBank kom seg.Ac
- Pubchem. (2018). Strontiumklorid. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov
- Okse. Mater. (2010). Påvirkning av granulært stontiumklorid som tilsetningsstoffer på submære elektriske og mekaniske egenskaper for ren polyvinylalkohol. Sci., Vol. 33, nei. 2, s. 149-155. Indian Academy of Sciences.
- CCOIL. (4. september 2009). Stontium-klorid-eksalt-3D-SF. [Figur]. Hentet 13. april 2018, fra: Commons.Wikimedia.org
- Alle reaksjoner. SRCL2 - Stontiumklorid. Gjenopprettet fra allreaksjoner.com