Difenylamin
- 1307
- 157
- Theodor Anders Hopland
Hva er defilaminen?
De Difenylamin Det er en organisk forbindelse hvis kjemiske formel er (C6H5)2NH. Navnet indikerer at det er en amin, så vel som formelen (-NH2). På den annen side refererer begrepet "diffenil" til tilstedeværelsen av to aromatiske ringer knyttet til nitrogen. Følgelig er defilamin et aromatisk amin.
Innenfor organiske forbindelser er det aromatiske ordet ikke nødvendigvis relatert til eksistensen av dets lukter, men til egenskaper som definerer deres kjemiske atferd mot visse arter.

Når det. Imidlertid kan grunnlaget eller mekanismene som styrer dets kjemiske reaksjoner forklares med dens aromatiske karakter, men ikke på grunn av dens hyggelige aroma.
Den kjemiske strukturen, basisiteten, aromatisiteten og intermolekylære interaksjoner er variablene som er ansvarlige for dens egenskaper: fra fargen på krystaller til anvendbarheten som et antioksidantmiddel.
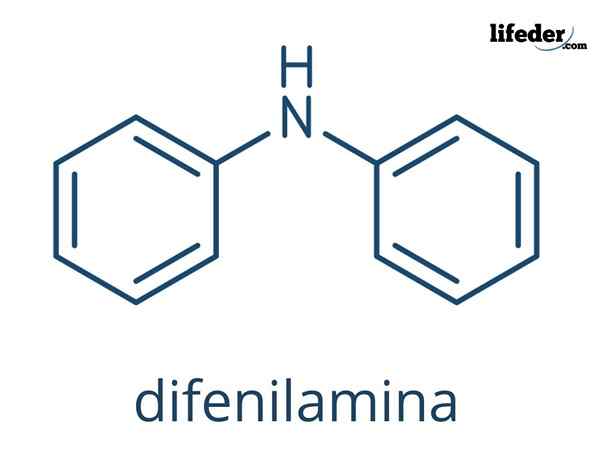
Kjemisk struktur av defilamin

I de overordnede bildene er de kjemiske strukturene til diffenilaminet representert. De svarte kulene tilsvarer karbonatomer, hvite til hydrogenatomer og blått til nitrogenatom.
Forskjellen mellom begge bildene er modellen for hvordan de representerer molekylet grafisk. I det nedre fremhever den aromatisiteten til ringene med linjene som er prikket i svart, og også den flate geometrien til disse ringene er bevist.
Ingen av de to bildene viser det ensomme paret av elektroner som ikke er delt på nitrogenatom. Disse elektronene "går" gjennom det konjugerte π -systemet til dobbeltbindinger i ringene. Dette systemet danner en slags sirkulerende sky som tillater intermolekylære interaksjoner; det vil si med andre ringer fra et annet molekyl.
Det kan tjene deg: Laboratorytermometer: Kjennetegn, hva er det for, bruk, eksemplerOvennevnte betyr at det ikke -delte nitrogenmomentet går gjennom begge ringene, og distribuerer i disse elektroniske tettheten, og deretter går de tilbake til nitrogen, for å gjenta syklusen igjen.
I denne prosessen avtar tilgjengeligheten av disse elektronene, noe som resulterer i en reduksjon i basisiteten til dipelaminet (dens tendens til å donere elektroner som en Lewis -base).
Dypenylaminbruk/applikasjoner
Difenylamin er et oksidasjonsmiddel som er i stand til å oppfylle en serie funksjoner, og blant dem er følgende:
- Under lagringen opplever epler og pærer en fysiologisk prosess som kalles skolding, relatert til produksjon av konjugerte trienoer, noe som fører til fruktenes hudskade. Dypenylaminvirkning gjør det mulig å øke lagringsperioden, noe som reduserer fruktskader på 10 % av det som observeres i deres fravær.
- Når du kjemper mot oksidasjon, utvider difenylamin og derivater funksjonen til motorer ved å unngå tykning av brukt olje.
- Diphenylamin brukes til å begrense ozonhandling i gummiproduksjon.
- Diphenylamin brukes i analytisk kjemi for nitratdeteksjon (nei3-), Klorater (clo3-) og andre oksidasjonsmidler.
- Det er en indikator som brukes i nitratforgiftningsdeteksjonstester.
- Når RNA hydrolyseres i en time, reagerer det med defilaminet; Dette tillater kvantifisering.
- I veterinærmedisin brukes dyp -pilamin lokalt i forebygging og behandling av manifestasjonene av boreridormen hos avlsdyr.
- Noen av duellaminderivater tilhører kategorien ikke-steroide antiinflammatoriske medisiner. De kan også ha farmakologiske og terapeutiske effekter som antimikrobielle, smertestillende midler, antikonvulsiva og anti -kreftaktivitet.
Dipenylaminpreparat
Naturligvis produseres definisjonen. Syntetisk er det mange ruter som fører til denne forbindelsen, for eksempel:
Termisk deaminering av anilin
Det er utarbeidet ved termisk deaminering av anilin (C6H5NH2) I nærvær av oksiderende katalysatorer.
Hvis anilin i denne reaksjonen ikke inkorporerer et oksygenatom i dets struktur, hvorfor oksiderer du deg? Fordi den aromatiske ringen er en elektrontraktorgruppe, i motsetning til H -atomet, som donerer den lave elektroniske nitrogentettheten i molekylet.
2 c6H5NH2 => (C5H5)2 NH+NH3
Anilin kan også reagere med anilinhydrokloridsalt (C6H5NH3+Cl-) under en oppvarming på 230 ºC i tjue timer.
C6H5NH2 + C6H5NH3+Cl- => (C5H5)2 NH
Fenotiazinreaksjon
Dypenylamin stammer fra flere avledede når de kombineres med forskjellige reagenser. En av disse er fenotiazin, som syntetiserer med svovel er en forløper for derivater med farmasøytisk handling.
(C6H5)2NH +2S => S (C6H4) NH +H2S

Dipenylaminegenskaper
Dipenylamin er et hvitt krystallinsk fast stoff som, avhengig av dets urenheter, kan skaffe seg bronkneal, rav eller gule toner. Den har en hyggelig blomsteraroma, den har en molekylvekt 169,23 g/mol og en tetthet på 1,2 g/ml.
Molekylene i disse faste stoffene interagerer av van der Waals-krefter, blant dem er hydrogenbroer dannet av nitrogenatomer (NH-NH) og stabling av aromatiske ringer, og hviler sine "elektroniske skyer" på den andre på den andre.
Kan tjene deg: sinksulfid (Zns)Som aromatiske ringer okkuperer mye. Ovennevnte fører til at det faste stoffet ikke har et veldig høyt fusjonspunkt (53 ºC).
Imidlertid er molekylene i flytende tilstand mer separate, og effektiviteten av hydrogenbroer forbedres. På samme måte er defilaminet relativt tung, og trenger mye varme for å bevege seg til en gassfase (302 ºC, kokepunktet). Dette skyldes også delvis vekten og interaksjonene til de aromatiske ringene.
Løselighet og grunnleggende
Det er veldig uoppløselig i vann (0,03 g/100 g vann) på grunn av den hydrofobe karakteren av dens aromatiske ring. I stedet er det veldig løselig i organiske løsningsmidler som benzen, karbontetraklorid (CCL4), aceton, etanol, pyridin, eddiksyre, etc.
Dens surhetskonstant (PKA) er 0,79, som refererer til surheten i dens konjugerte syre (C6H5NH3+). Protonet som er tilsatt nitrogen har en tendens til en del, fordi paret med elektroner som det er koblet sammen med kan gå gjennom de aromatiske ringene. Dermed høy ustabilitet C6H5NH3+ Det gjenspeiler den lave basisiteten til diffenilamin.
Referanser
- Lubrizol Corporation. (2018). Difenylamin -antioksidanter. Gjenopprettet fra Lubrizol.com
- Arun Kumar Mishra, Arvind Kumar. (2017). Farmakologiske anvendelser av difenylamin og dens derivat som potent bioaktiv forbindelse: en gjennomgang. Gjeldende bioaktive forbindelser, volum 13.
- Prepchem. (2015-2016). Forberedelse av difenylamin. Gjenopprettet fra Prepchem.com
- Pubchem. (2018). Difenylamin. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Wikipedia. (2018). Difenylamin. Innhentet fra.Wikipedia.org

