Jernholdig klorid (FECL2) struktur, bruksområder, egenskaper

- 4315
- 784
- Oliver Christiansen
Han jernholdig klorid Det er et uorganisk fast stoff dannet av foreningen av en troskation2+ og to anioner klorid cl-. Den kjemiske formelen er fecl2. Det har en tendens til å absorbere vann fra miljøet. En av hydratene er fekl tetrahydrat2 •4H2Eller som er et grønnaktig fast stoff.
Fremhev at den er veldig løselig i vann og har en tendens til å lett oksidere i nærvær av luft som danner jernfeklklorid3. For å være lett oksidable og derfor i stand til å fungere som en reduksjon er mye brukt i kjemiske og biologiske forskningslaboratorier.
 Ferroso tetrahydrat klorid fecl2 •4H2Eller solid. Craven [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Ferroso tetrahydrat klorid fecl2 •4H2Eller solid. Craven [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Jernholdig klorid har flere bruksområder for å hjelpe andre midler i oksidasjon av slam avledet fra avløpsvann eller avløpsbehandling. Det brukes også i metalljernbeleggingsprosessen og har noen bruksområder i legemiddelindustrien.
FECL -bruk har også blitt opplevd2 I utvinningen av verdifulle metaller av de brukte katalysatorene som finnes i eksosrørene til kjøretøyer som fungerer med bensin eller diesel.
Det brukes i tekstilindustrien for å fikse farger i noen typer stoff.
[TOC]
Struktur
Jernholdig klorid dannes av et jernholdig trosion2+ og to ioner klorid cl- Forent gjennom ioniske lenker.
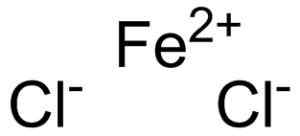 Ferroso Chloruro Fecl2 Hvor er ionene som utgjør det. EPOP [Public Domain]. Kilde: Wikimedia Commons.
Ferroso Chloruro Fecl2 Hvor er ionene som utgjør det. EPOP [Public Domain]. Kilde: Wikimedia Commons. Den jernholdige troen2+ Den har følgende elektroniske struktur:
1s2, 2s2 2 s6, 3s2 3p6 3d6, 4s0
Hvor du kan se at du mistet to elektroner i 4S -laget.
Denne konfigurasjonen er ikke veldig stabil, og av denne grunn har den en tendens til å oksidere, det vil si miste et annet elektron, denne gangen av 3D -laget, og danner trosionen3+.
For sin del- Den har følgende elektroniske struktur:
1s2, 2s2 2 s6, 3s2 3p6
Hvor du kan se at du skaffet deg et ekstra elektron i lag 3P, og fullførte det. Denne konfigurasjonen er veldig stabil fordi alle elektroniske lag er komplette.
Nomenklatur
- Jernholdig klorid
- Jernklorid (II)
Det kan tjene deg: Bestemmelse av aske: Metoder og eksempler- Jerndiklorid
- Tetrahydrat jernholdig klorid: FECL2 •4H2ENTEN
Egenskaper
Fysisk tilstand
Fargerik til blekgrønne, krystaller.
Molekylær vekt
126,75 g/mol
Smeltepunkt
674 ºC
Kokepunkt
1023 ºC
Spesifikk vekt
3.16 til 25 ºC/4 ºC
Løselighet
Veldig løselig i vann: 62,5 g/100 ml ved 20 ºC. Løselig i alkohol, aceton. Litt løselig i benzen. Praktisk talt uoppløselig i eter.
Andre egenskaper
Fecl2 vannfri er veldig hygroskopisk. Absorbere vann med enkel miljø, danner en rekke hydrater, spesielt tetrahydratet, der for hvert FECL -molekyl2 Det er 4 timers molekyler2Eller koblet til dette (FECL2 •4H2ENTEN).
I nærvær av luft er det sakte oksiderende til FECL3. Dette betyr at troen2+ Oksiderer lett ionetro3+.
Hvis du varmer opp i nærvær av hurtig luft jernklorid fecl3 Og jernoksid Fe2ENTEN3.
Fecl2 Det er etsende for metaller og vev.
Å skaffe
Det oppnås ved å behandle et overskudd av jerntro med vandig løsning av HCl -saltsyre ved høye temperaturer.
Tro0 + 2 HCl → FECL2 + 2 h+
På grunn av tilstedeværelsen av vann gjennom denne metoden oppnås imidlertid jernholdig tetrahydratklorid2 •4H2ENTEN.
For å oppnå vannfri (uten vann innarbeidet i krystallene) har noen forskere valgt å utføre reaksjonen av jernstøv med åser vannfri (uten vann) i tetrahydrofuranoppløsningsmidlet (THF) ved en temperatur på 5 ° C.
FECL -forbindelsen oppnås på denne måten2 •1,5THF, som når den er oppvarmet til 80-85 ºC i tomrommet eller i nitrogenatmosfære (for å unngå tilstedeværelse av vann) produserer FECL2 vannfri.
applikasjoner
Jernholdig klorid har forskjellige bruksområder basert på dens reduserende kapasitet, det vil si at det lett kan oksideres. Det brukes for eksempel i malerier og belegg, da det hjelper til med å fikse dem fra overflaten.
Jern er et essensielt mikronæringsstoff for menneskers helse og noen dyr. Det er involvert i proteinsyntese, pust og multiplikasjon av celler.
Derfor fecl2 Det brukes i farmasøytiske preparater. Troen2+ Som sådan er det bedre absorbert enn troen3+ I tarmen.
Kan tjene deg: kalsiumkarbonat: struktur, egenskaper, formasjon, brukDet brukes til FECL -produksjon3. Det brukes i metallurgi, i jernbelegg, for å gi en mer duktil avsetning.
Her er andre fremtredende bruksområder.
I stofffarging
Fecl2 Det brukes som en mordant eller fargelegging i noen typer stoff. Mordanten reagerer kjemisk og blir samtidig med fargestoffet og stoffet som danner en uoppløselig forbindelse på dette.
På denne måten er fargestoffet festet til stoffet og fargen intensiveres.
 Jernholdig klorid fecl2 Lar farger fikses på stoffer. Gina Pina [CC av 2.0 (https: // creativecommons.Org/lisenser/av/2.0)]. Kilde: Wikimedia Commons.
Jernholdig klorid fecl2 Lar farger fikses på stoffer. Gina Pina [CC av 2.0 (https: // creativecommons.Org/lisenser/av/2.0)]. Kilde: Wikimedia Commons. I avløpsbehandling
Fecl2 Det brukes i avløpsvann eller avfallsbehandlingsanlegg (kloakkvann).
I denne applikasjonen deltar jernholdig klorid i oksidasjon av gjørmen, gjennom en prosess som kalles fentonoksidasjon. Denne oksidasjonen forårsaker brudd på gjørmeflokkene og tillater frigjøring av vann som er sterkt festet til dette.
 Del av et renseanlegg hvor du kan se gjørmen. Noen ganger blir dette behandlet med Ferroso Fecl -klorid2 slik at det lettere kan skilles fra vann. Evelyn Simak/avløpsarbeid nord for Dickleburgh. Kilde: Wikimedia Commons.
Del av et renseanlegg hvor du kan se gjørmen. Noen ganger blir dette behandlet med Ferroso Fecl -klorid2 slik at det lettere kan skilles fra vann. Evelyn Simak/avløpsarbeid nord for Dickleburgh. Kilde: Wikimedia Commons. Da kan gjørmen tørke og kaste. Bruk av jernholdig klorid hjelper til med å redusere prosesskostnadene.
Det er også nylig blitt foreslått å redusere dannelsen av sulfidgass eller hydrogensulfid i nevnte kloakk av kloakk.
På denne måten ville korrosjonen produsert av denne gassen og den ubehagelige lukten reduseres.
I kjemiske studier
For de reduserende egenskapene (det motsatte av oksidasjon) FECL2 Det er mye brukt i forskjellige forskning innen kjemi, fysikk og ingeniørlaboratorier.
Visse forskere brukte jernholdig klorid damp.
Disse katalysatorene brukes til å eliminere skadelige gasser for menneske og miljø. De ligger i rømningsrøret med biler og lastebiler som jobber med bensin eller diesel.
Kan tjene deg: molmasse: hvordan den beregnes, eksempler og løste øvelser Eksosrør med et kjøretøy der det observeres et mer omfangsrikt seksjon, det er der katalysatoren er lokalisert for å konvertere skadelige gasser til vennlige gasser med miljøet. Ahanix1989 på engelsk Wikipedia [Public Domain]. Kilde: Wikimedia Commons.
Eksosrør med et kjøretøy der det observeres et mer omfangsrikt seksjon, det er der katalysatoren er lokalisert for å konvertere skadelige gasser til vennlige gasser med miljøet. Ahanix1989 på engelsk Wikipedia [Public Domain]. Kilde: Wikimedia Commons. Etter en viss tid blir katalysatoren for kjøretøyet brukt og mister effektiviteten, og du må erstatte den. Den brukte katalysatoren kasseres og det arbeides for å gjenvinne de verdifulle metaller som den inneholder.
 Keramisk rutenett av katalysatoren der sporene av verdifulle metaller for å komme seg med FECL er lokalisert2. GLOBAL-KAT Gjenvinning [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Keramisk rutenett av katalysatoren der sporene av verdifulle metaller for å komme seg med FECL er lokalisert2. GLOBAL-KAT Gjenvinning [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. I følge forskerne dannet disse metallene med jern fra jernholdig klorid magnetiske legeringer.
Legeringene kunne trekkes ut med magneter og deretter gjenvunnet de verdifulle metaller ved allerede kjente metoder.
I biokjemiske studier
For å ha troskation2+, som er et viktig mikronæringsstoff i mennesket og noen dyr, Fecl2 Det brukes i biokjemi og medisinstudier.
Enkelte studier tillot å demonstrere at jernholdig klorid forbedrer soppdrepende effekt av argon kaldt plasma.
Kald plasma er en teknologi som brukes til sterilisering av medisinske overflater og instrumenter. Det er basert på dannelsen av hydroksylradikaler oh · fra miljøets fuktighet. Disse radikaler reagerer med celleveggen i mikroorganismen og forårsaker deres død.
I denne undersøkelsen FECL2 Effekten av kaldt plasma forbedret og akselererte eliminering av en soppresistent mot andre desinfeksjonsmetoder.
Noen forskere fant ut at bruken av FECL2 Det tillater økende ytelse i glukose som oppnår reaksjoner basert på sukkerrør bagasse.
I dette tilfellet å være tro2+ En essensiell mikroement for menneskers helse, dens tilstedeværelse i spor i produktet ville ikke påvirke mennesket.
Referanser
- Fukuda, s. et al. (2019). Jernholdig klorid og jernholdig sulfat forbedrer den soppdrepende effekten av kald atmosfærisk argonplasma på melaniserte aureobasidium pullulans. J Biosci Bioeng, 2019, 128 (1): 28-32. NCBI kom seg.CLM.NIH.Gov.
- Ismal, eller.OG. og yildirim, l. (2019). Metall gags og biomordanter. I virkningen og utsiktene til grønn kjemi for tekstilteknologi. Kapittel 3, PP.57-82. Gjenopprettet fra Scientedirect.com.
- Zhang, w. et al. (2019). Kokatalyse av magnesiumklorid og jernholdig klorid for xylo-oligosakkarider og glukoseproduksjon fra sukkerrør bagasse. Bioresoral Technol 2019, 291: 121839. NCBI kom seg.NLM.NIH.Gov.
- Zhou, x. et al. (2015). Rollen av urfolks jern for å forbedre slamvannbarhet denne peroksidasjonen. Vitenskapelige rapporter 5: 7516. NCBI kom seg.NLM.NIH.Gov.
- Rathnayake, d. et al. (2019). Hydrogensulfidkontroll i kloakk ved å katalysere reaksjonen med oksygen. Science of the Total Environment 689 (2019) 1192-1200. NCBI kom seg.NLM.NIH.Gov.
- Taninouchi, og. og Okabe, t.H. (2018). Gjenvinning av platinagruppemetaller fra brukte katalysatorer ved bruk av jernkloriddampbehandling. Metall og Materi Trans B (2018) 49: 1781. Lenke gjenopprettet.Springer.com.
- ELLER.S. National Library of Medicine. (2019). Jernholdig klorid. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov.
- Aresta, m. et al. (1977). Jern (0) Oksidasjon ved hydrogenklorid i tetrahydrofuran: Enkel vei til vannfri jern (II) klorid. Uorganisk kjemi, vol. 16, nei. 7, 1977. Gjenopprettet fra puber.ACS.org.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- « Portugal flagghistorie og mening (reviderte bilder)
- Christian Ethics Origin, Fundamentals, Representanter »

