Kvaternære forbindelser Karakteristikker, trening, eksempler
- 4689
- 113
- Thomas Karlsen
De Kvaternære forbindelser De er alle de som har fire forskjellige atomer eller ioner. Derfor kan de være molekylære eller ioniske arter. Diversitetene dekker både organisk og uorganisk kjemi, og er en veldig klumpete gruppe; Skjønt kanskje ikke så mye sammenlignet med binære eller ternære forbindelser.
Årsaken til at antallet ditt er mindre er fordi de fire atomene eller ionene må holdes forent av deres kjemiske tilhørigheter. Ikke alle elementer er kompatible med hverandre, og enda mindre når de anses som en kvartett; Plutselig er et par av dem mer relatert til hverandre enn med det andre paret.
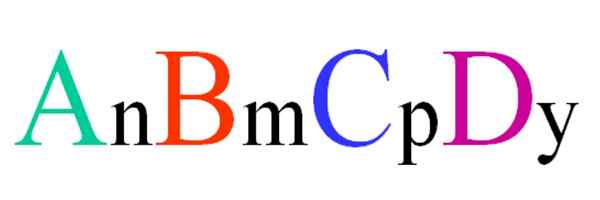 Generell og tilfeldig formel for en kvartær forbindelse. Kilde: Gabriel Bolívar.
Generell og tilfeldig formel for en kvartær forbindelse. Kilde: Gabriel Bolívar. Tenk på en kvartær forbindelse av ABCD tilfeldig formel. Abonnementene N, M, P E Y, er de støkiometriske koeffisientene, som igjen indikerer hvilken andel av hvert atom det er i forhold til de andre.
Dermed formel AnBmCpDog Det vil være gyldig hvis det oppfyller elektronærutring. I tillegg vil en slik forbindelse være mulig hvis de fire atomene deres er nær nok med hverandre. Det vil sees at denne formelen ikke gjelder mange forbindelser, men spesielt for legeringer eller mineraler.
[TOC]
Kjennetegn på kvartære forbindelser
Kjemikalier
En kvartær forbindelse kan være ionisk eller kovalent, og viser de forventede egenskapene for sin natur. ABCD -ioniske forbindelser forventes å være oppløselige i vann, alkoholer eller i andre polare løsningsmidler; De må ha høye kokende og fusjonspunkter, og være gode strømførere når de smelter sammen.
Når det gjelder ABCD -kovalente forbindelser, består de fleste av nitrogen, oksygenert eller halogenerte organiske forbindelser; det vil si at formelen vil bli cnHmENTENpNog eller cnHmENTENpXog, X Å være et halogenatom. Av disse molekylene ville det være logisk å tro at de var polare, gitt de høye elektronegativitetene til O, N og X.
Kan tjene deg: natriumklorid (NaCl)En rent kovalent ABCD-forbindelse kan ha mange koblingsmuligheter: A-B, B-C, D-A, etc., Avhengig av atomer og elektroniske evner til atomer. Mens det er i en rent ionisk ABCD -forbindelse, er interaksjonene elektrostatisk: a+B-C+D-, For eksempel.
Når det gjelder en legering, ansett som mer en fast blanding enn en forbindelse som er riktig talende, består ABCD av nøytrale atomer i basale tilstander (i teorien).
Av resten kan en ABCD -forbindelse være nøytral, syre eller basisk, avhengig av identiteten til dens atomer.
Fysisk
Fysisk sett er det sannsynlig at ABCD ikke blir en gass, fordi fire forskjellige atomer alltid involverer en større molekylmasse eller formulerer. Hvis det ikke er en væske med et høyt kokepunkt, forventes det å være et fast stoff, hvis nedbrytning må generere mange produkter.
Igjen, dets farger, lukt, tekstur, krystaller osv., De vil bli utsatt for hvordan de sameksisterer A, B, C og D i forbindelsen, og vil avhenge av deres synergi og strukturer.
Nomenklatur
Så langt har spørsmålet om kvartære forbindelser blitt adressert på en global og upresis måte. Forlater organisk kjemi til side (AMIDAS, Benchilo -klorider, kvartær ammoniumsalter, etc.), I uorganisk kjemi er det godt definerte eksempler som kalles sure og grunnleggende oksisaler.
Syreoksaler
Syreoksisaler er de som stammer fra delvis nøytralisering av en polyprotisk oksoacid. Dermed erstattes en eller flere av hydrogenene av metallkationer, og jo mindre resterende hydrogen besitter, jo mindre sure vil det være.
For eksempel fosforsyre, h3Po4, Opptil to syresalter kan fås fra, for å si, natrium. Disse er: nah2Po4 (Na+ erstatter et hydrogen som tilsvarer H+) og na2Hpo4.
Kan tjene deg: selen: historie, egenskaper, struktur, innhenting, brukI følge den tradisjonelle nomenklaturen er disse saltene navngitt så vel som oksisalene (helt ubeskyttet), men før ordet 'syre' til metallets navn. Dermed nah2Po4 Det ville være natriumdase fosfat, og NA2Hpo4 Natriumsyrefosfat (fordi det har en H har.
På den annen side foretrekker bestandsnomenklaturen å bruke ordet 'hydrogen' den 'syre'. Nah2Po4 Det ville være å være natriumdihydrogen, og NA2Hpo4 Hydrogen -natriumfosfat. Merk at disse saltene har fire atomer: Na, H, P og O.
Grunnleggende oksaler
Grunnleggende okser er de som inneholder anion oh i deres sammensetning-. Tenk for eksempel saltkano3Å (ca2+ NEI3- Åh-). For å nevne det, ville det være nok å gi ordet 'grunnleggende' til metallens navn. Dermed ville navnet hans være: grunnleggende kalsiumnitrat. Og hva med Cuio3Åh? Hans navn ville være: Cupric Basic Yodato (Cu2+ Io3- Åh-).
I følge bestandsnomenklaturen erstattes ordet 'grunnleggende' av hydroksyd, etterfulgt av bruk av et skript før oksoanionens navn.
Gjenta de tidligere eksemplene at navnene deres ville være for hver enkelt: kalsiumhydroksyd-nitrat og kobberhydroksyd-andodat (II); Husker at metall Valencia må være angitt i parentes og med romertall.
Doble salter
I doble salter er det to forskjellige kationer som samhandler med samme type anion. Anta at dobbeltsaltet: Cu3Tro (Po4)3 (Cu2+ Tro3+ Po43-). Det er et jern- og kobberfosfat, men det mest passende navnet for å referere til dette er: trippel kobber (II) og jern (III) fosfat.
Hydratiserte salter
Dette er hydrater, og den eneste forskjellen er at på slutten av navnene er antallet vannformuleringer spesifisert. For eksempel MNCL2 Det er manganklorid (ii).
Kan tjene deg: Benzoine: Struktur, egenskaper, bruksområderHans hydrat, MNCL2· 4H2O Det kalles manganklorid (ii) tetrahydrat. Merk at det er fire forskjellige atomer: Mn, CL, H og O.
Et kjent dobbelt og hydrert salt er Mohrs, tro (NH4)2(SW4)2· 6H2ENTEN. Hans navn er: dobbelt jernsulfat (II) og heksahydrat ammonium.
Opplæring
Igjen, med fokus på uorganiske kvartære forbindelser, har vi stort sett et produkt av delvise nøytraliseringer. Hvis disse forekommer i nærvær av flere metalloksider, er doble salter sannsynlig; Og hvis mediet er veldig grunnleggende, vil de grunnleggende oksisalene utfelle.
Og hvis i tillegg, derimot, har vannmolekyler en affinitet til metall, vil de direkte koordinere seg med det eller med de omkringliggende ionene, og danne hydratene.
På siden av legeringene må fire forskjellige metaller eller metalloider sveises for fremstilling av kondensatorer, halvledere eller transistorer.
Eksempler
Til slutt vises en liste med forskjellige eksempler på kvartære forbindelser nedenfor. Leseren kan bruke den til å teste sin kunnskap om nomenklatur:
- PBCO3(ÅH)2
- CR (HSO4)3
- Nahco3
- Znioh
- Cu2(ÅH)2SW3
- Li2Kaso4
- Cuso4· 5H2ENTEN
- Agau (så4)2
- Sak4· 2H2ENTEN
- FECL3· 6H2ENTEN
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Uorganisk nomenklatur og formulering. [PDF]. Hentet fra: Ressurser.utdanning.er
- Erika thalîa bra. (2019). Doble salter. Akademi. Gjenopprettet fra: Akademi.Edu
- Wikipedia. (2019). Kvartær ammoniumkation. Hentet fra: i.Wikipedia.org

