Kjemisk konsentrasjon

- 5049
- 972
- Thomas Karlsen
 Kjemisk konsentrasjon er det som bestemmer andelen av et løst stoff og et løsningsmiddel i en kjemisk løsning
Kjemisk konsentrasjon er det som bestemmer andelen av et løst stoff og et løsningsmiddel i en kjemisk løsning Hva er kjemisk konsentrasjon?
De Kjemisk konsentrasjon Det er en egenskap av løsningene som representerer mengden oppløst for hver løsningsenhet. Det er med andre ord et tall som indikerer andelen som oppløsningen og løsningsmidlet er lokalisert.
Husk at en løsning er en homogen blanding dannet av et løsningsmiddel (generelt væske) og ett eller flere stoffer oppløst i løsningsmidlet vi kaller oppløste stoffer. Løsningene er preget av løsningsmidlet, oppløsningen og konsentrasjonen.
Konsentrasjonen er en veldig nyttig eiendomsegenskap, siden den lar oss beskrive dem. For eksempel, hvis vi vet at konsentrasjonen av salt i sjøvann er 35 gram for hver liter, så vet vi at vi i huset vårt løser opp 35 gram salt i en liter løsning, vil vi få en like løsning av salt som sjøvann.
Kjennetegn på kjemisk konsentrasjon
Det er en intensiv eiendom
Dette er hovedkarakteristikken ved konsentrasjon. Intensiv betyr at det ikke avhenger av mengden løsning vi har. Som et eksempel betyr dette at konsentrasjonen er den samme i en dråpe sjøvann enn i 100 liter av den samme.
Kan variere med temperatur
Generelt utvides eller øker væskene volumet når du varmer opp. Dette gjelder også for løsninger. Av denne grunn kan konsentrasjonene som er uttrykt avhengig av volum, endres litt når du varmer eller avkjøler løsningen.
Det kan dekke veldig bredt rekkevidde
Uansett enhetene som en kjemisk konsentrasjon er uttrykt, kan den ha fra relativt store verdier, til ekstremt små verdier.
For eksempel kan konsentrasjonen av en løsning uttrykt i prosent ha verdier fra 0% til 100%, og dekker dermed mange størrelsesordener. Vi kunne utarbeide en 90%løsning, da vi også kunne forberede en av 10-12%, som er nesten 14 bestillinger av mindre størrelsesorden.
Hva er kjemisk konsentrasjon for?
Å kjenne konsentrasjonen av en løsning lar oss beskrive den. Det er mange egenskaper for løsninger som er avhengige av konsentrasjonen deres. For eksempel avhenger smelte- og kokepunktet av konsentrasjonen, så å vite at det lar oss beregne disse to egenskapene.
Kan tjene deg: glassaktig tilstandPå den annen side lar konsentrasjonen oss enkelt sammenligne en løsning med en annen. Hvis vi har to vannløsninger med sukker, vil det å vite at konsentrasjonene deres vil tillate oss å vite hvilke av de to som er søtere.
I tillegg avhenger alle kjemiske reaksjoner som gjør livet mulig sterkt av konsentrasjonen av uendelige oppløste stoffer i celler og omgivelsene til levende vesener.
For eksempel avgjør konsentrasjonen av oksygen i luften om en person vil kveles eller ikke; PH i en løsning (som er en måte å måle konsentrasjonen av H -ioner+) Bestemme om en bakterie vil leve og reprodusere, eller om det tvert imot vil dø; og konsentrasjonen av en gift vil avgjøre om den vil være dødelig eller ikke.
Typer konsentrasjonsenheter
Konsentrasjonen av en løsning er en, så det er ikke riktig å snakke om typer konsentrasjon. Imidlertid kan den samme konsentrasjonen uttrykkes i forskjellige typer konsentrasjonsenheter. Disse er:
- Fysiske konsentrasjonsenheter
- Kjemiske konsentrasjonsenheter
Fysiske konsentrasjonsenheter
Disse er preget av ved å uttrykke mengder av oppløsning og løsningsmiddel enten i masseenheter eller volum. De kalles fysiske enheter, siden de er assosiert med masser og volumer i stedet for føflekker og tilsvarende.
Når vi sammenligner to løsninger som har samme fysiske konsentrasjon, kan vi ikke sikre at de har like store mengder atomer og molekyler. Dette er det som skiller dem fra kjemiske konsentrasjonsenheter.
De vanligste fysiske konsentrasjonsenhetene er:
- Enkel tittel (TS)
- %vekt/vekt (%p/p) eller masse/masse (%m/m)
- %vekt/volum (%p/v) eller masse/volum (%m/v)
- % volum/volum (% v/v)
- Deler per million vekt/vekt (ppmp/p) eller masse/masse (ppmm/m)
- Deler per million vekt/volum (ppmp/v) eller masse/volum (ppmm/v)
- Deler per million volum/volum (ppmV/v)
Kjemiske konsentrasjonsenheter
Når det.
De kalles kjemiske enheter, siden to løsninger som har samme kjemiske konsentrasjon har likeverdige mengder atomer, molekyler eller oppløsteioner per løsningsenhet, som tilfellet kan være.
Kan tjene deg: Løselighetsregler: Generelle aspekter og reglerDe vanligste kjemiske enhetene er:
- Molaritet (m)
- Molalitet (m)
- Molar fraksjon (x)
- Normalitet (N)
Formel for fysiske konsentrasjonsenheter
Enkel tittel (TS)
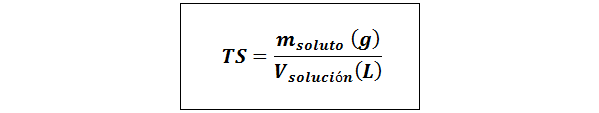
Hvor mløst representerer massen av oppløsningen i gram og vløsning Det er volumet av løsningen i liter.
%vekt/vekt (%p/p) eller masse/masse (%m/m)
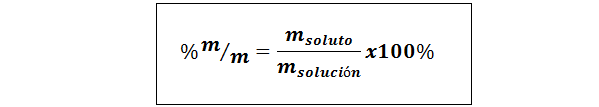
Hvor mløst og Mløsning henholdsvis representerer massen av løsningen og løsningen. Enhver masseenhet kan brukes (g, mg, kg, etc.), så lenge begge massene er uttrykt i samme enhet.
%vekt/volum (%p/v) eller masse/volum (%m/v)
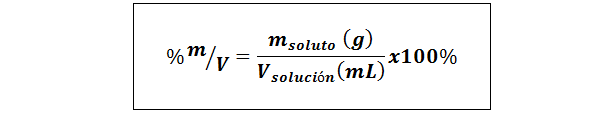
Hvor mløst Det er massen av løsningen i gram og vløsning Det er volumet av løsningen, i dette tilfellet i milliliter.
% volum/volum (% v/v)

Hvor vløst og vløsning henholdsvis representerer volumet av oppløsningen og løsningen. I dette tilfellet kan enhver enhet brukes til å uttrykke disse volumene, så lenge den er den samme for begge.
Deler per million vekt/vekt (ppmp/p) eller masse/masse (ppmm/m)
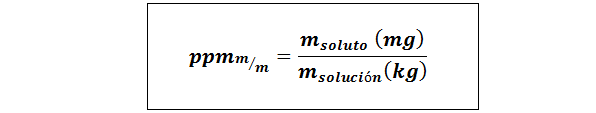
Hvor mløst og Mløsning De representerer massen av oppløsningen og løsningen i henholdsvis milligram og kilo.
Deler per million vekt/volum (ppmp/v) eller masse/volum (ppmm/v)
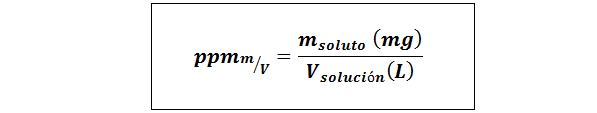
Hvor mløst Det er massen av løsningen i milligram og vløsning Det er volumet av løsningen, i dette tilfellet i liter.
Deler per million volum/volum (ppmV/v)
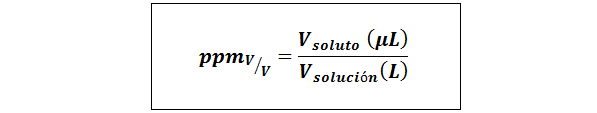
Hvor vløst og vløsning De er volumet av oppløsningen og løsningen i henholdsvis mikroliter og liter.
Formler av de kjemiske konsentrasjonsenhetene
Når det. Disse mengdene har det reelle antallet partikler (atomer, molekyler eller ioner, som tilfellet kan være).
Disse mengdene kan ikke være kjent bare ved å veie eller måle volumet av stoffer, men det er nødvendig å kjenne sammensetningen eller den kjemiske formelen til forbindelsene for å bestemme konsentrasjonen. Dette er hovedårsaken til at de kalles kjemiske konsentrasjoner.
Deretter presenteres de forskjellige formlene for å beregne de fire mest brukte kjemiske konsentrasjonene:
Molaritet (m)
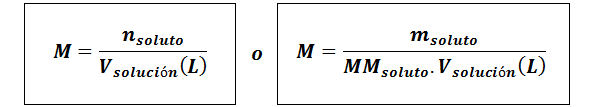
Hvorløst De er molene av løst stoff, mløst Representerer massen av oppløsningen i gram, mmløst er dens molmasse og vløsning Det er volumet av løsningen i liter.
Molalitet (m)
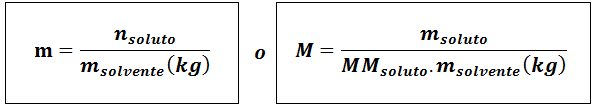
Hvorløst De er molene av løst stoff, mløst Representerer massen av oppløsningen i gram, mmløst Det er dens molmasse og mløsemiddel Det er massen av løsningsmidlet i kilo.
Kan tjene deg: solvasjonMolar fraksjon (x)
Den molære fraksjonen kan beregnes for både løsemidlet og løsningsmidlet. Den molære fraksjonen av oppløsningen er:
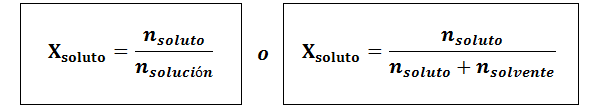
Løsningsmidlet er:
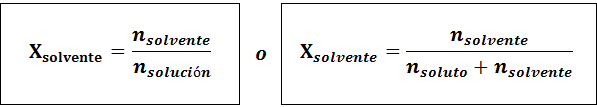
Forholdet mellom begge molære fraksjoner er:
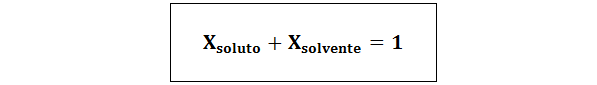
I alle tilfeller nløst, nløsning og nløsemiddel er molene med henholdsvis løsning, løsning og løsningsmiddel.
Normalitet (N)
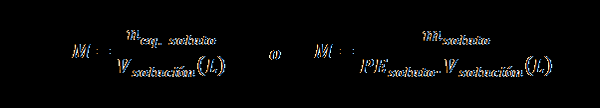
Her nEq. løst representerer antall ekvivalenter av løsningen, mløst representerer massen av oppløsningen, PEløst Det er den tilsvarende vekten av oppløsningen og vløsning Det er volumet av løsningen i liter.
Eksempler på kjemisk konsentrasjon
- Konsentrasjonen av salt i marint vann er 35 g/l, noe som tilsvarer en molaritet på 0,60 mol/l.
- Den gjennomsnittlige blodsukkerkonsentrasjonen er mellom 82 mg/dL og 110 mg/dL. Disse konsentrasjonene tilsvarer en enkel tittel på 0,82 g/l og 1,10 g/l, og i molaritet ved 4,4.10-3 mol/l og 6.1.10-3 mol/l, henholdsvis.
- Luften kan betraktes som en gassoppløsning som hovedsakelig dannes av nitrogen og oksygen, og løsningsmidlet er nitrogen, siden det er i større andel. Denne gassløsningen inneholder en 0,22 oksygen og nitrogenfraksjon på omtrent 0,78.
- Stål er en legering mellom jern og karbon. Selv om de ikke er strengt løsninger, er dette homogene faste blandinger som vanligvis inneholder en karbonkonsentrasjon i størrelsesorden 0,03% og 1.075% i masse.
- Til tross for sine ødeleggende effekter for miljøet og for menneskers helse, er konsentrasjoner av mange miljøgifter vanligvis betydelig lave. Et eksempel er den maksimale konsentrasjonen av arsen giftig metall i vann. Verdens helseorganisasjon (WHO) slo fast at drikkevann ikke skulle inneholde en arsenkonsentrasjon større enn 10 ppb m/v (deler per milliard eller nanogram per liter). Denne konsentrasjonen tilsvarer 0.010 ppm m/v.
Referanser
- BBC (s. F.). Konsentrasjon av løsninger - Beregninger i kjemi - AQA - GCSE Chemistry (Single Science) Review - AQA. BBC tatt.co.Storbritannia.
- Her er hva konsentrasjon betyr i kjemi (2020). Taket fra Thoughtco.com.
- Librettexts (2022). 4.5: Konsentrasjon av løsninger. Hentet fra Chem.Librettexts.org.
- Mandal, a., MD. (2021). Normale blodsukkerverdier. Hentet fra nyhetsmedisinsk.nett.
- Kjemikalier.Nett (s. F.). Kjemiske konsentrasjoner. Hentet fra kjemier.nett.

