Ekstern elektronisk konfigurasjon
- 2868
- 494
- Magnus Sander Berntsen
 Elektroniske orbitaler. Kilde: Patricia.Fidi, Wikimedia Commons
Elektroniske orbitaler. Kilde: Patricia.Fidi, Wikimedia Commons Hva er ekstern elektronisk konfigurasjon?
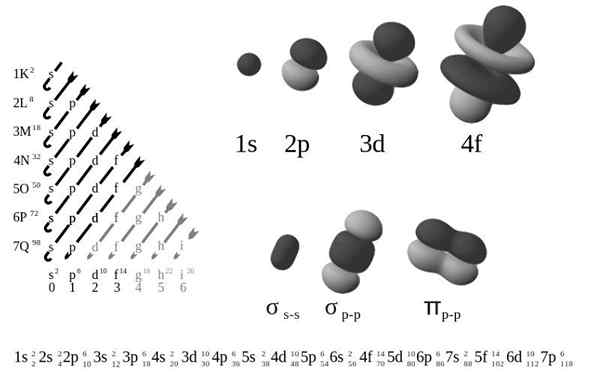
De Ekstern elektronisk konfigurasjon, Også kalt elektronisk struktur, det er arrangementet av elektroner i nivåer og underkjøringer med energi rundt en atomkjerne. Nivåene er fra 1 til 7, og undernivåene er S, P, D og F.
I følge Bohrs gamle atommodell okkuperer elektroner flere nivåer i baner rundt kjernen, av det første laget nærmest kjernen, k, til det syvende laget, Q, den fjerneste.
Når det.
Vanligvis brukes elektronisk konfigurasjon for å beskrive orbitalene til et atom i dets grunnleggende tilstand, men det kan også brukes til å representere et atom som har blitt ionisert i en kation eller anion, og kompenserer med tap eller gevinst av elektroner i sine respektive orbitaler.
Mange av de fysiske og kjemiske egenskapene til elementene kan korreleres med deres unike elektroniske konfigurasjoner. Valencia -elektroner, elektroner i det ytterste laget, er den avgjørende faktoren for elementets unike kjemi.
Grunnleggende konsepter for elektroniske konfigurasjoner
Før man tildeler elektronene til et atom til orbitalene, må man bli kjent med de grunnleggende konseptene for elektroniske konfigurasjoner. Hvert element i den periodiske tabellen består av atomer, som er sammensatt av protoner, nøytroner og elektroner.
Elektronene viser en negativ belastning og er rundt atomets kjerne i elektronet orbitaler, definert som volumet på plassen der elektronet kan bli funnet innen 95% sannsynlighet.
De fire forskjellige typene orbitaler (S, P, D og F) har forskjellige måter, og en orbital kan inneholde maksimalt to elektroner. Orbitaler P, D og F har forskjellige underutstyr, slik at de kan inneholde flere elektroner.
Kan tjene deg: Batchreaktor: Kjennetegn, deler, applikasjonerSom indikert er den elektroniske konfigurasjonen til hvert element unik for sin posisjon i den periodiske tabellen. Energinivået bestemmes av perioden, og antall elektroner er gitt av atomnummeret til elementet.
Orbitaler på forskjellige energinivåer ligner hverandre, men okkuperer forskjellige områder i verdensrommet.
1s orbital og orbital 2s har egenskapene til en orbital S (radioknuter, sannsynlighet for sfærisk volum, kan bare inneholde to elektroner, etc.). Men som er på forskjellige nivåer av energi, okkuperer de forskjellige rom rundt kjernen. Hver orbital kan representeres med spesifikke blokker i det periodiske tabellen.
S -blokken er regionen av alkaliske metaller, inkludert helium (gruppe 1 og 2), blokk D er overgangsmetaller (gruppe 3 til 12), blokk P er elementene i hovedgruppen av grupper 13 a 18, og blokk F er serien med lantanider og aktinider.
Aufbau -prinsippet
Aufbau kommer fra det tyske ordet Aufbauen, Hva betyr "build". I hovedsak, når vi skriver elektronkonfigurasjoner, bygger vi elektron -orbitaler når vi går fra et atom til et annet.
Når vi skriver den elektroniske konfigurasjonen av et atom, vil vi fylle orbitalene i økende rekkefølge av atomnummer.
Aufbau -prinsippet stammer fra Paulis eksklusjonsprinsipp, som sier at det ikke er to fermioner (for eksempel elektroner) i et atom. De kan ha samme sett med kvantetall, så de må "samle seg" på høyere energinivå.
Måten elektroner samler seg på er et elektronkonfigurasjonsproblem.
De stabile atomene har like mange elektroner som protonene gjør i kjernen. Elektronene møtes rundt kjernen i kvantebaner, etter fire grunnleggende regler kalt Aufbau -prinsippet.
Kan tjene deg: bariumklorid (BACL2)1. Det er ingen to elektroner i atomet som deles av de samme fire kvantetallene N, L, M og S.
2. Elektroner vil først okkupere orbitalene på det laveste energinivået.
3. Elektronene vil alltid fylle orbitalene med samme spinnnummer. Når orbitalene er fulle, begynner den.
4. Elektroner vil fylle orbitaler for summen av kvantetall n og l. Orbitaler med likeverdige verdier (n + l) vil bli fylt først med lavere N -verdier.
Andre og fjerde regler er i utgangspunktet de samme. Et eksempel på regel fire ville være orbitaler 2p og 3s.
En orbital 2p er n = 2 og l = 2 og en 3s orbital er n = 3 og l = 1. (N + l) = 4 i begge tilfeller, men 2p -orbitalen har den laveste energien eller lavere verdien og vil bli fylt før lag 3s.
Heldigvis kan du bruke Moeller -diagrammet som er vist å fylle elektroner. Grafen leses ved å utføre diagonalene fra 1s.
 Moeller -diagram. Kilde: Gabriel Bolívar
Moeller -diagram. Kilde: Gabriel Bolívar Nå som det er kjent at ordens rekkefølge er fylt, er det eneste som gjenstår å huske størrelsen på hver orbital.
Orbitaler har en mulig verdi av ml Å inneholde 2 elektroner
P orbitals har 3 mulige verdier av ml Å inneholde 6 elektroner
Orbitaler har 5 mulige verdier av ml Å inneholde 10 elektroner
F orbitals har 7 mulige verdierl Å inneholde 14 elektroner
Dette er alt som trengs for å bestemme den elektroniske konfigurasjonen av et stabilt atom av et element.
Ta for eksempel nitrogenelementet. Nitrogen har syv protoner og derfor syv elektroner. Den første orbitalen å fylle er orbital 1 -ene.
En orbital S har to elektroner, så det er fem elektroner igjen. Den neste orbitalen er 2s orbital og inneholder de to neste. De tre endelige elektronene vil gå til 2p -orbitalen som kan inneholde opptil seks elektroner.
Kan tjene deg: karboksymetylcelluloseViktigheten av ekstern elektronisk konfigurasjon
Elektronkonfigurasjoner spiller en viktig rolle i å bestemme atomegenskaper.
Alle atomer i samme gruppe har den samme eksterne elektroniske konfigurasjonen med unntak av atomnummeret n, og det er grunnen til at de har lignende kjemiske egenskaper.
Noen av nøkkelfaktorene som påvirker atomegenskaper inkluderer størrelsen på de største okkuperte orbitalene, energien til de mest energibaner, antall orbitale ledige stillinger og antall elektroner i orbitalene med større energi.
De fleste atomegenskap.
Elektronene i det ytre laget er de som kan danne kovalente kjemiske bindinger, som har evnen til å ion til å danne kationer eller anioner og de som gir oksidasjonstilstand til de kjemiske elementene.
De vil også bestemme atomradius. Når n blir større, øker atomradius. Når et atom mister et elektron, vil det være en sammentrekning av atomradiusen på grunn av reduksjonen i negativ belastning rundt kjernen.
Elektronene i det ytre laget tas i betraktning av Valencia Link Theory, Theory of the Crystalline Field and Molecular Orbital Theory for å oppnå egenskapene til molekylene og hybridiseringene av bindingene.
Referanser
- Aufbau Main. Chem kom seg.Librettexts.org.
- Bozeman Science. Elektronkonfigurasjon. Gjenopprettet fra YouTube.com.
- Elektronkonfigurasjoner og atomets egenskaper. Gjenopprettet fra Oneonta.Edu.

