Galvaniske korrosjonsmekanismer, eksempler, beskyttelse

- 1792
- 514
- Jonathan Carlsen
De Galvanisk eller elektrokjemisk korrosjon Det er en prosess der et metall eller legering blir mer svært svært i sammenlignet med dens konvensjonelle oksidasjon. Det kan sies at det er en akselerert oksidasjon, og til og med med vilje ledet; som i batterier eller batterier.
Dette foregår under en serie forhold. Først må det være et aktivt metall, kalt anode. Også, og for det andre må det være litt reaktivt edelt metall som kalles katode. Tredje og fjerde forhold er tilstedeværelsen av et medium der elektroner er spredt, for eksempel vann og ionisk eller elektrolyttarter.
 Oksidert jernkrone. Kilde: Pixnio.
Oksidert jernkrone. Kilde: Pixnio. Galvanisk korrosjon er observerbar, spesielt i marine miljøer eller på bredden av strendene. Luftstrømmer løfter vanndampmasser, som igjen drar noen ioner; Sistnevnte ender opp med å feste seg til et tynt lag med vann eller dråper som hviler på metalloverflaten.
Disse forholdene for fuktighet og saltholdighet favoriserer metallkorrosjon. Det vil si at en jernkrone som den i det overordnede bildet vil oksidere raskere hvis det blir utsatt for havets nærliggende.
Enkel som et metall vil måtte oksidere sammenlignet med et annet, kan måles kvantitativt gjennom reduksjonspotensialene; I kjemibøkene er det florete bord med disse potensialene og. Jo mer negativt, jo større er din tilbøyelighet til å oksidere.
Hvis dette metallet er i nærvær av et annet med et veldig positivt reduksjonspotensial, og derfor har oksidasjonen av det reaktive metallet mer aggressiv med en stor ΔE. Andre faktorer, som pH, ionisk kraft, fuktighet, tilstedeværelsen av oksygen og forholdet mellom områdene til metallet som er oksidert og det som er redusert, er også viktig.
[TOC]
Mekanismer
Konsepter og reaksjoner
Før du adresserer mekanismene bak galvanisk korrosjon, må visse konsepter avklares.
I en reaksjon rédox mister en art elektroner (oksidert) mens en annen vinner dem (den reduseres). Elektroden som oksidasjon skjer kalles anode; Og som reduksjonen skjer, blir katode (på engelsk vanligvis brukt Redcat å huske).
For en elektrode (ett stykke, skrue osv.) av et metall m, hvis dette er oksidert, sies det at det er anoden:
M => mn+ + ne-
Antall frigitte elektroner vil være lik størrelsen på den positive belastningen av kation mn+ resulterende.
Deretter mottar en annen elektrode eller metall (begge metaller være i kontakt på noen måte), mottar de frigjorte elektronene; Men dette lider ikke en kjemisk reaksjon hvis de får elektroner, siden det bare ville utføre dem (elektrisk strøm).
Derfor må det være en annen art i løsning som disse elektronene formelt kan akseptere; Så lett å redusere metallioner, for eksempel:
Kan tjene deg: inhomogent systemRn+ + ne- => R
Det vil si at et lag med metall R ville danne seg og elektroden ville bli tyngre; mens metall m ville miste masse fordi atomene deres oppløses.
Depolarisatorer
Og hvis det ikke var noen metallkationer som kunne reduseres tilstrekkelig? I så fall vil andre arter som er til stede i midten ta elektroner: depolarizadores. Disse er intimt relatert til ph: o2, H+, Åh- og h2ENTEN.
Oksygen og vann får elektroner i en reaksjon uttrykt ved følgende kjemiske ligning:
ENTEN2 + 2H2O + 4E- => 4OH-
Mens ioner h+ De forvandles til h2:
2H+ + 2e- => H2
Det vil si oh art- og h2 De er vanlige produkter av galvaniske eller elektrokjemiske korrosjoner.
Selv om metall R ikke deltar i noen reaksjon, er det mer edelt at M fremmer oksidasjonen; Og følgelig vil det være en større produksjon av OH -ioner- O hydrogengass. For tross alt er det forskjellen mellom reduksjonspotensialer, ΔE, en av hovedmotorene i disse prosessene.
Jernkorrosjon
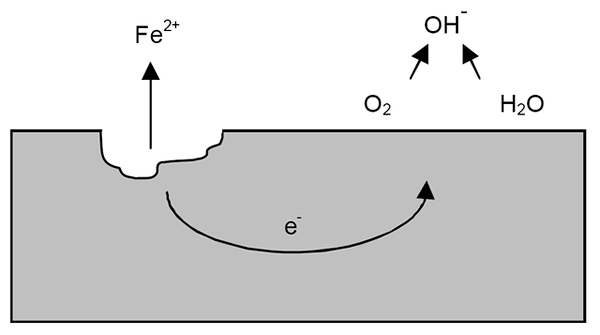 Korrosjonsmekanisme for jern. Kilde: Wikipedia.
Korrosjonsmekanisme for jern. Kilde: Wikipedia. Etter de tidligere avklaringene kan eksemplet med jernkorrosjon (overlegen bilde) tas opp. Anta at det er et tynt lag med vann der oksygen oppløses. Uten tilstedeværelse av andre metaller vil det være depolarizadorene som vil markere reaksjonsretningslinjene.
Dermed vil jern miste noen atomer på overflaten for å oppløses i vann som troskationer2+:
Fe => Tro2+ + 2e-
De to elektronene vil reise jernstykket for å være en god strømleder. Slik at det er kjent hvor oksidasjon eller anodisk sted begynte; Men ikke der reduksjonen eller plasseringen av det katodiske stedet vil fortsette. Det katodiske stedet kan være hvor som helst; Og jo høyere dets mulige område, verre vil være korrosjonen av metallet.
Anta at elektroner når et punkt som vist i det øvre bildet. Det er både oksygen og vann lider reaksjonen som allerede er beskrevet, som OH frigjøres-. Disse anionene oh- De kan reagere med tro2+ Å danne tro (å)2, som utfeller og lider påfølgende oksidasjoner som til slutt forvandler det til rust.
I mellomtiden sprekker det anodiske stedet mer og mer.
Eksempler
I dagliglivet er eksemplene på galvaniske korrosjoner mange. Vi trenger ikke å referere til jernkronen: enhver gjenstand laget av metaller kan lide den samme prosessen i nærvær av våte og saltvannsmiljøer.
Kan tjene deg: fosfatgruppeI tillegg til stranden, kan vinteren også bidra med de ideelle forholdene for korrosjon; For eksempel når du kaster salter til vegsnøen for å forhindre at biler skøyter.
Fra det fysiske synspunktet, i de sveisede fagforeningene av to metaller, kan det beholde fuktighet, og være aktive korrosjonssteder. Dette er fordi begge metaller oppfører seg som to elektroder, og de mest reaktive vil miste elektronene sine.
Hvis oh ionproduksjon- Det er betydelig, du kan til og med kjøre malingen av bilen eller den aktuelle gjenstanden.
Anodiske indekser
Man kan bygge sine egne eksempler på galvaniske korrosjoner ved bruk av reduksjonspotensielle tabeller. Imidlertid vil den anodiske indekstabellen (forenklet av seg selv) bli valgt for å illustrere dette punktet.
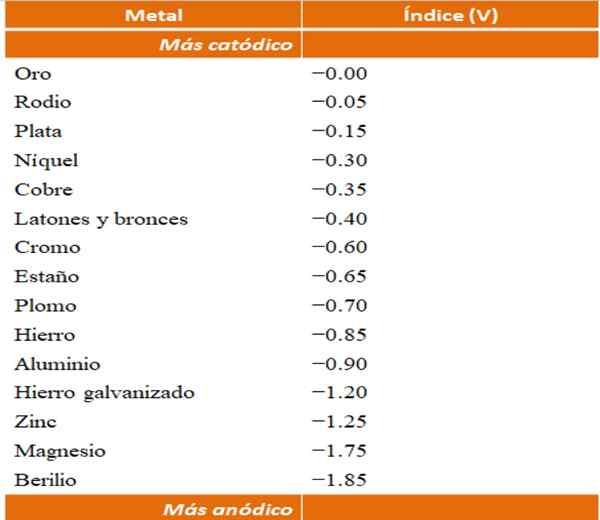 Anodiske indekser for forskjellige metaller eller legeringer. Kilde: Wikipedia.
Anodiske indekser for forskjellige metaller eller legeringer. Kilde: Wikipedia. Anta for eksempel at vi ønsker å bygge en elektrokjemisk celle. Metallene som er den øvre delen av tabellen anodiske indekser er mer katode; det vil si at de lett reduseres, og det vil derfor være vanskelig å ha dem i løsning. Mens metaller som er i bunnen er mer anodiske eller reagenser, og lett kjører.
Hvis vi velger gull og beryllium, kunne ikke begge metaller være sammen på lang tid, siden beryllium ville oksidere med ekstrem rask.
Og hvis det tvert imot har vi en agionløsning+ Og vi fordyper en aluminiumsbar i den, den vil løse opp samtidig som de utfeller metall sølvpartikler. Hvis denne linjen kobles til en grafittelektrode, ville elektroner reise til den for å elektrokjemisk avsette sølv som en sølvfilm.
Og hvis i stedet for aluminiumstangen er ute av kobber, ville løsningen bli blåaktig av tilstedeværelsen av ionene Cu2+ i vann.
Beskyttelse mot elektrokjemisk korrosjon
Ofre belegg
Anta at det er ment å beskytte en lamina av korrosjon i nærvær av andre metaller. Det enkleste alternativet ville være å tilsette magnesium, som ville dekke sink slik at elektronene som frigjøres fra magnesium reduserer Zn -kationene, når de oksyder, reduserer Zn -kationene som ble oksidert,2+ tilbake.
Imidlertid ville MGOs film om sink før heller enn senere ende opp med å sprekke, og gi nåværende sted med høy tetthet; det vil si at sinkkorrosjon ville akselerere kraftig rett på disse punktene.
Denne teknikken for beskyttelse mot elektrokjemisk korrosjon er kjent som bruk av offerkledning. Den mest kjente er sink, brukt i den berømte teknikken som kalles galvanisering. I dem er metall m dekket, spesielt jern, sink (tro/Zn).
Kan tjene deg: Phenolphthalein (C20H14O4)Igjen oksiderer sink og oksydet tjener til å dekke jern og overføre elektroner som reduserer troen2+ som kan dannes.
Edle belegg
Anta at du igjen vil beskytte det samme sinkarket, men nå vil krom brukes i stedet for magnesium. Krom er mer edelt (mer katodisk, se bordet med anodiske indekser) enn sink, og det er derfor det fungerer som et edelt belegg.
Problemet med denne typen belegg er at når det sprekker, vil det fremme og akselerere oksidasjonen av metallet nedenfor; I dette tilfellet er sink korrodert enda mer enn å bli dekket med magnesium.
Og til slutt er det andre belegg som består av malerier, plast, antioksidanter, fett, harpiks, etc.
Barnas eksperiment
Jernplate i kobbersalter
Et enkelt eksperiment kan utvikles fra samme tabell med anodiske indekser. Oppløser et rimelig beløp (mindre enn 10 gram) CUSO4· 5H2Eller i vann, blir et barn bedt om å fordype en polert jernplate. Et bilde tas og prosessen har lov til å utvikle seg i et par uker.
Oppløsningen er opprinnelig blåaktig, men den vil begynne å miste fargen mens jernplaten skaffer seg en coppy -farge. Dette er fordi kobber er edelt enn jern, og derfor kationer Cu2+ De vil bli redusert til metallkobber fra ionene som er tildelt ved oksidasjon av jern:
Fe => Tro2+ + 2e-
Cu2+ + 2e- => Cu
Sølvoksydrensing
Silver gjenstander blir svart over tid, spesielt hvis de er i kontakt med en kilde til svovelforbindelser. Oksydet kan fjernes hvis gjenstanden er nedsenket i et vannkar med natriumbikarbonat og aluminiumsfolie. Bikarbonat gir elektrolytter som vil lette transport av elektroner mellom objektet og aluminium.
Som et resultat kan barnet sette pris på at gjenstanden mister sine svarte flekker og vil skinne med sin karakteristiske sølvfarge; Mens aluminiumsfolien vil løpe til de forsvinner.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2019). Galvanisk korrosjon. Hentet fra: i.Wikipedia.org
- Stephen Lower. (16. juni 2019). Elektokjemisk korrosjon. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Det åpne universitetet. (2018). 2.4 Korrosjonsprosess: Galvanisk korrosjon. Gjenopprettet fra: Åpne.Edu
- Customer Technical Service Brush Wellman Inc. (s.F.). En guide til galvanisk korrosjon. Brush Wellman -konstruerte materialer.
- Giorgio Carboni. (1998). Eksperimenter ved elektokjemi. Hentet fra: Fensci.com
- « Sofist relativisme opprinnelse, egenskaper, eksempler
- Syklisk hydrokarbonsstruktur, egenskaper, eksempler »

