Elektrofile reaksjoner, eksempler, elektrofilisitet
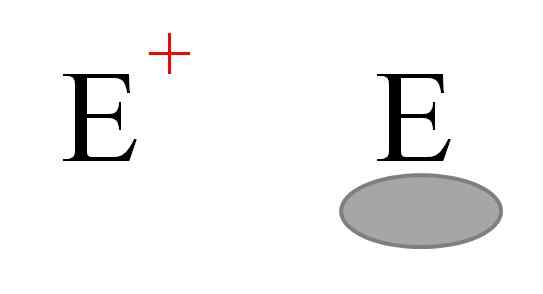
- 1988
- 364
- Prof. Oskar Aas
EN Elektrofil Det er alt det kjemiske arten (atom eller molekyl) som ser ivrig ut et par elektroner. Ordet betyr 'kjærlighet til elektroner'. Derfor vil en elektrofi alltid ha en tendens til å vinne eller akseptere elektroner når du deltar i kjemiske reaksjoner.
Hva som gjør en elektrofil til behov for elektroner? Du må ha en elektronmangel, enten du er manifestert av en delvis eller total positiv belastning, eller av et elektronisk ledig stilling av en ufullstendig valensoktett. Det vil si at vi har flere typer elektrofiler, selv om de alle godtar par elektroner av negative arter.
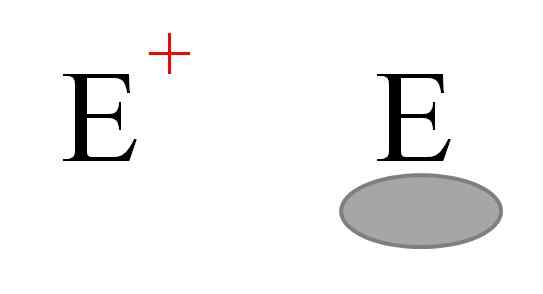 De to hyppigste typene elektrofiler i kjemi. Kilde: Gabriel Bolívar.
De to hyppigste typene elektrofiler i kjemi. Kilde: Gabriel Bolívar. To typer elektrofiler er generelt representert. Begge er symbolisert med brevet og. Den til venstre tilsvarer en positiv belastningselektrofi, og+. I mellomtiden tilsvarer den til høyre en elektrofil med elektronisk ledig stilling, representert av en gråaktig oval som indikerer fraværet av elektroner i en orbital i Valencia.
Metallkationer er eksempler på elektrofiler og+, så vel som noen polyiatomiske ioner som hydronium, h3ENTEN+. Alhs molekyler3 og bf3, På den annen side er de eksempler på den andre typen elektrofiler, siden både aluminium og boratom har en elektronmangel fordi de ikke fullfører oktet av Valencia.
[TOC]
Reaksjoner
Elektrofiler reagerer aksepterende atomelektronpar med høye negative tettheter, det vil si elektronrik. Disse negative atomer eller molekyler kalles nukleofiler, Nu-, som donerer et par elektroner til elektrofi og e e+:
Wildebeest- + OG+ → Nu-e
Dette er det teoretiske grunnlaget for mange organiske reaksjoner, for eksempel aromatisk elektrofil substitusjon. Nukleofilen trenger ikke nødvendigvis å være en anion, men det kan også være et nøytralt molekyl med et elektronegativt atom, for eksempel nitrogen.
Kan tjene deg: silisium: historie, egenskaper, struktur, innhenting, brukEksempler på elektrofiler
Lewis syrer
Lewis -syrer er elektrofiler, fordi de per definisjon godtar elektronpar. Metalliske kationer, mn+, tiltrekke de negative regionene i de omkringliggende polare molekylene i oppløsningsprosessene. Dermed mn+ ender opp med å omgi negative belastninger, til og med kommer til å akseptere elektroner for å danne koordinasjonskomplekser.
Cucion Cu2+, For eksempel er det en Lewis -syre og en elektrofil fordi den er koordinert med vannoksygenatomer for å danne en kompleks ACU2)62+. På samme måte skjer det med andre kationer.
Ikke alle Lewis -syrer er kationer: noen er nøytrale molekyler eller atomer. For eksempel BF3 Det er en Lewis -syre og en elektrofil fordi.
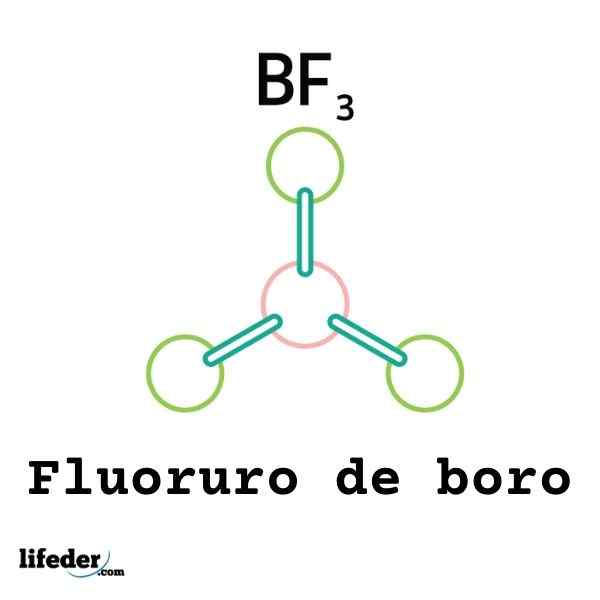
Dermed vil det kobles til en omliggende fluoranion for å danne Boro Tetrafluoruro -anion, BF4-. Det vil si BF3 danner en kobling med f- ved å godta et par av elektronene sine.
En annen elektrofi er nitronio ion, nei2+, hvilken er en Elektrofylisk middel veldig sterkt dannet i nitreringsreaksjonene av benzen. I det ionet har nitrogenatom en positiv belastning, så benzenelektronene godtar raskt.
Brönsted syrer
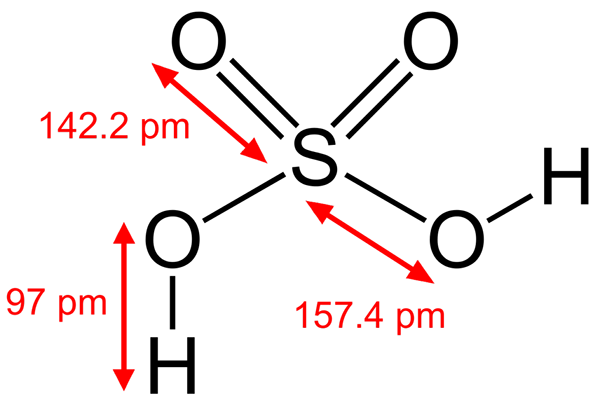 Svovelsyrestruktur
Svovelsyrestruktur Noen Brönsted -syrer er også elektrofiler. For eksempel hydroniumkation, h3ENTEN+, Det er en elektrofil fordi oksygenatomet har en positiv belastning. Å være veldig elektronegativ, vil du søke å få elektroner som donerer et av hydrogenene for å transformere til et vannmolekyl.
Nok en Brönsted -syre som svovelsyre, H2SW4, Det er også en elektrofil. Svovelatom er sterkt oksidert, og vil søke å få elektroner som donerer sine to hydrogener.
Kan tjene deg: karbontetraklorid (CCL4)Halogener
Halogener (f2, Cl2, Br2 og jeg2) De er elektrofiler. Atomene har ingen elektroniske mangler; Imidlertid er koblingene deres ustabile, fordi begge atomene, X-X, veldig sterkt tiltrekker elektroner til dem.
Derfor reagerer halogener som oksidasjonsmidler, og oppfører seg som elektrofiler og aksepterer elektronpar for å bli halogenidanioner (f-, Cl-, Br- og jeg-).
Halogener vinner imidlertid ikke bare elektroner på denne måten. De kan også knyttes til mindre elektronegative atomer enn dem for å oppnå en netto elektronforsterkning. For eksempel er dette grunnen til at de kan legges til dobbeltbindinger av alkener eller olefiner.
Halogener representerer en annen type elektrofi til de to som ble introdusert i begynnelsen. Imidlertid er dens oppførsel på slutten den samme som for alle elektrofiler: godta elektronpar.
Leie og hydrogenhalogenider
 CFC -molekyler er alkylhalogenider
CFC -molekyler er alkylhalogenider Leie- og hydrogenhalogenider er elektrofiler der halogenforbundet atom har en sterk elektronisk mangel representert med Δ -symbolet+. Dette er fordi halogenet, sterkt elektronegativt, tiltrekker seg den elektroniske tettheten til det nærliggende atomet til seg selv.
For alkylhalogenider, Rx, vil R ha en elektronisk mangel mens x overflødig elektron, rΔ+-XΔ-. Så hvis en veldig negativ art nærmer seg Rx, vil den angripe R for å koble seg til den og få X til å komme ut som en anion.
I hydrogenhalogenider har Hx også en elektronisk mangel eller en positiv delvis belastning, hΔ+-XΔ-. Derfor vil negative arter gi elektronene sine til dette hydrogenet, og han som elektrofil vil akseptere dem.
Karbonylforbindelser
Syrer, halogener og halogenider er ikke de eneste molekylene som kan klassifiseres som elektrofiler. Selv om ikke, karbondioksid, CO2, Det er en elektrofil, fordi det sentrale karbonatom er veldig oksidert, eller = CΔ+= O.
Kan tjene deg: flat bakgrunnsflaskeDerfor, når CO -2 Reacta vil gjøre det å akseptere elektronpar, enten bli karboksylat, COOH -gruppe eller karbonatanionen, CO32-.
I tillegg til CO2, Karbonylforbindelser, for eksempel ketoner, aldehyder og estere er også eksempler på elektrofiler, fordi karbon i dem har en positiv delvis belastning og har en tendens til å akseptere elektroner av veldig negative arter.
Karbokasjoner
 Metan karbonatom positivt lastet
Metan karbonatom positivt lastet Karbokasjoner er ekstraordinært sterke Lewis -syrer. Det er tertiær (r3C+), sekundær (r2HC+) eller primær (RH2C+). Karbon danner alltid fire bindinger, så spesielt denne kationen vil søke hvordan man aksepterer elektroner på noen måte.
Elektrofilisitet
Ikke alle elektrofiler er like "sultne" av elektroner. Noen er mer reaktive enn andre. Jo større elektronisk elektrofilmangel, desto større er dens følsomhet for å lide nukleofile angrep av negative arter. Det vil si at den vil presentere større elektrofylitet, som er det relative målet for hvor reaktiv er den aktuelle elektrofilen.
For eksempel har karbokasjoner, nitronium og fluor høy elektrofylaity; Mens karbondioksid eller noen kationer som natrium har lav elektrofylacy.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10. utgave.). Wiley Plus.
- Wikipedia. (2020). Elektrofil. Hentet fra: i.Wikipedia.org
- James Ashenhurst. (2020). Nukleofiler og elektrofiler. Gjenopprettet fra: MasterorganicChemistry.com
- Professor Patricia Shaley. (2012). Nukleofiler og elektrofiler. University of Illinois. Gjenopprettet fra: Butan.Chem.Uiuc.Edu
- Danielle Reid. (2020). Elektrofil: Definisjon og eksempel. Studere. Gjenopprettet fra: Studie.com
- Tim Soderberg. (7. oktober 2019). Elektrofiler. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- « Biot-Savart Law Formula, demonstrasjon, applikasjoner, øvelser
- Shelfords toleranselov hva som består og eksempler »

