Interne elektroner

- 2521
- 197
- Mathias Aas
Vi forklarer hva interne elektroner er, deres egenskaper og gir flere eksempler
Hva er indre elektroner?
Hver gang vi tenker på et atom, forestiller vi oss en kjerne dannet av protoner og nøytroner, omgitt av elektronene som roterer rundt den, på samme måte som planetene dreier seg om solen.
Men ikke alle elektroner er de samme, og to klasser kan skilles ut, avhengig av hvor nær eller langt de er fra atomkjernen.
Noen er lenger fra kjernen og kalles Valencia -elektroner. Disse er ansvarlige for alle kjemiske reaksjoner vi kjenner. På den andre siden, De som er nærmest kjernen og er sterkere forent den, er de vi kaller interne elektroner.
Kjennetegn på indre elektroner
De er de mest stabile elektronene
Som en generell regel, jo lavere energinivået til et elektron, er dette mer stabilt. Interne elektroner okkuperer orbitaler ved de laveste energinivåene til et atom, derfor er de også de mest stabile elektronene.
De er sterkere forent til kjernen
Kjernen tiltrekker seg elektroner fordi begge har motsatte belastninger: kjernen er positiv mens negative elektroner. Denne kraften øker når avstanden avtar.
Som en konsekvens av dette er indre elektroner, som er de som er nærmest kjernen, også de som er sterkest knyttet til det samme. Av samme grunn er de også de vanskeligste elektronene å fjerne.
De er ikke en del av de kjemiske bindingene
Når det ene atomet nærmer seg et annet, er det første å berøre deres ytterste elektroner. Av denne grunn er det bare Valencia -elektroner som griper inn i kjemiske reaksjoner. Interne elektroner eller deltar i kjemiske bindinger, og de er heller ikke involvert i kjemisk reaksjon.
Det kan tjene deg: hvor mange forvaringselektroner har karbon?De er veldig skjermende
Dette betyr at indre elektroner står mellom ytre elektroner og kjernen, og skaper en slags skjerm som reduserer kraften som kjernen tiltrekker seg elektroner av valens.
De kommer alltid i par
I hver orbital er det bare to elektroner med motsatte spinn, som kalles sammenkoblede elektroner (som er en annen måte å si at de danner et par). Som orbitaler der indre elektroner er lokalisert, er de alltid helt fulle, så disse elektronene er alltid sammenkoblet.
Hvordan vet vi hvor mange indre elektroner har et atom har?
Å vite hvor mange indre elektroner som har et atom er veldig enkelt. Du trenger bare å vite hvor mange elektroner atomet har, og hvor mange av disse elektronene som tilhører Valencia -laget. Alle andre elektroner er indre elektroner.
Men hvordan finner vi ut disse tallene? I de følgende seksjoner forklarer vi det.
Det totale antall elektroner er lik atomnummeret
Ettersom atomer er nøytrale (det vil si at de ikke har noen netto elektrisk ladning), må de ha samme antall positive belastninger (protoner) som negative belastninger (elektroner). Ettersom atomnummeret indikerer hvor mange protoner som er i kjernen, så indikerer det også hvor mange elektroner et atom er rundt når det er nøytralt.
Når det gjelder ioner, som i motsetning til atomer har elektrisk ladning, oppnås det totale antall elektron.
Eksempler
- Karbonatomet (C) er element nummer 6 i den periodiske tabellen (det er dets atomnummer). Derfor har karbonatomet 6 elektroner totalt.
- Natriumionet (i) (na+) har en positiv ladning på +1, og atomantallet natrium er 11. Så det totale antall elektroner i dette ionet er: 11 - (+1) = 10 elektroner.
- Kloridionet (CL-) har en negativ belastning på -1, og atomnummeret til klor er 17. Så det totale antall elektroner i dette ionet er: 17 - ( - 1) = 17 + 1 = 18 Elektroner.
Valencias antall elektroner er lik sin gruppe i det periodiske bordet
Elementene som tilhører gruppe 1A (de alkaliske metaller) har alle 1 elektron av Valencia. De som tilhører den andre (alkaliner) har 2, de av 3. (Boro Group, aluminium, gallium, etc.) De har 3 og så videre. Dette gjelder ikke overgangsmetaller.
Som før blir ionene trukket fra å beregne valenselektronene sine.
Eksempler
- Oksygen tilhører gruppe 6A for det som har 6 valenselektroner.
- Sulfidionet (s2-) Den tilhører også gruppe 6A, men har en belastning på -2, så den har: 6 -( -2) = 6 + 2 = 8 Valencia -elektroner.
Eksempler på forskjellige atomer og deres indre elektroner
Interne karbonelektroner (C)

Som vi så et øyeblikk siden, har karbon 6 elektroner totalt. I tillegg tilhører den gruppe 4A for det som har 4 elektroner av Valencia, så det har totalt 6 - 4 = 2 interne elektroner.
Intern nitrogenelektroner (N)
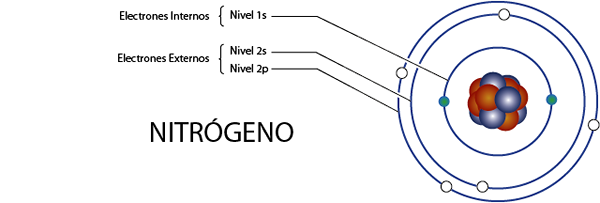
Nitrogen har 7 elektroner totalt. I tillegg tilhører den gruppe 5A for det som har 5 elektroner av Valencia, så det har totalt 7 - 5 = 2 interne elektroner.
Interne elektroner av argon (AR)
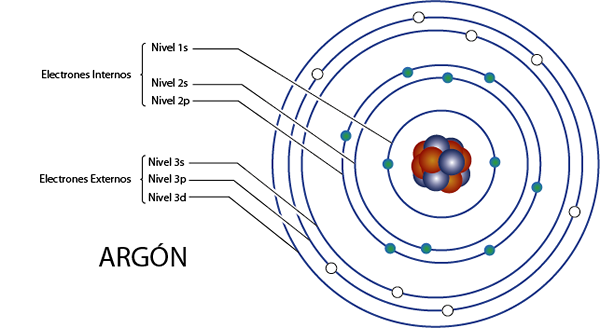
Argon er element 18 for det som har 18 elektroner totalt. I tillegg tilhører den gruppe 8a for det som har 8 elektroner av Valencia, så det har totalt 18 - 8 = 10 interne elektroner.
Interne elektroner av kloridionet (CL-)
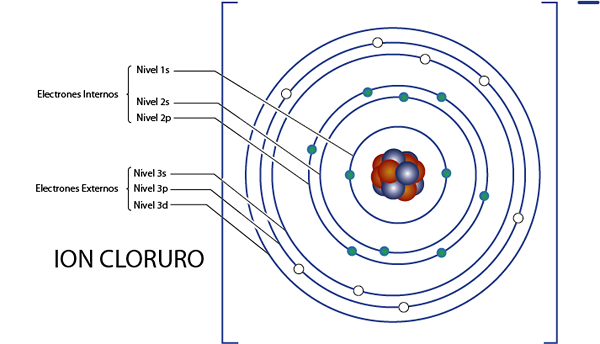
Som vi så for et øyeblikk siden, har klorid 18 elektroner totalt. I tillegg tilhører den gruppe 7A og har belastning -1, så den har 7 - ( - 1) = 8 Valencia -elektroner. Så den har 18 - 8 = 10 interne elektroner, Som Argon.
Det kan tjene deg: Nukleær kjemi: Historie, studieretning, områder, applikasjonerInterne elektroner av kalsium +2 ion (CA2+)
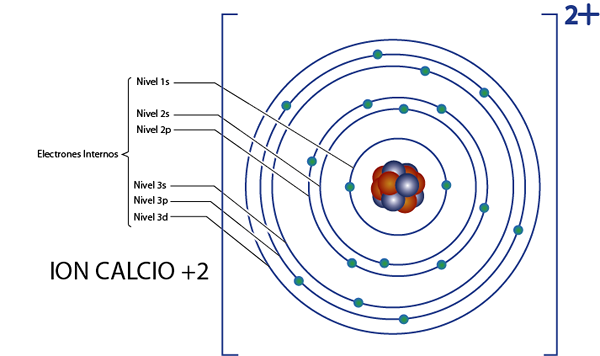
Kalsium er element 20, og dette ionet har 2 positive ladninger, så det har totalt 20 - 2 = 18 elektroner rundt kjernen. Dette elementet tilhører gruppe 2A og ettersom belastningen er +2, har den ikke valenselektroner (2 - 2 = 0). Av denne grunn er alle 18 elektronene som er igjen av kalsium de som opprinnelig var de indre elektronene.
Det er to elementer som ikke har indre elektroner
De to lettere elementene i det periodiske tabellen, som er hydrogen (H) og helium (HE), har bare 1 og 2 elektroner henholdsvis. Begge elektronene er på det eneste energinivået som disse atomene har, som er nivå 1.
Av denne grunn tilsvarer disse elektronene valenselektronene til disse to elementene. Siden det ikke er lavere energinivå, så er det heller ingen interne elektroner.

