Elementer, forbindelser og blandinger
- 4678
- 751
- Theodor Anders Hopland
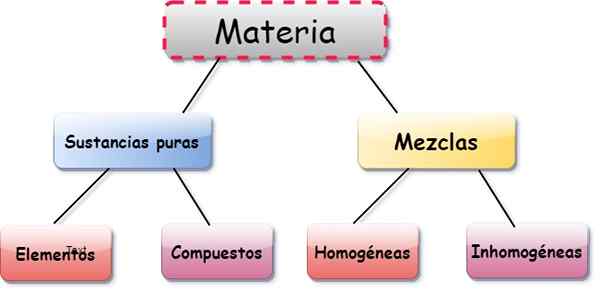
Elementer, forbindelser og blandinger er tre former for presentasjon av materie. De gjenstander De er stoffer som er utgjøret av en enkelt atom, forbindelser De er kombinasjoner mellom to eller flere elementer, og blandinger De følger av sammensetningen av flere elementer og stoffer.
Komponentene i blandingene skilles gjennom fysiske midler. For å skille elementene i en forbindelse, må kjemiske prosedyrer utføres.
Det er ingen måte å skille dem inn i mindre komponenter med ordinære metoder, men det er måter å sprekke atomer. Faktisk er fisjon en måte å hente ut energi fra dem.
Atomene som utgjør en viss forbindelse, gjør det alltid i faste proporsjoner. For sin del, i en blanding, kan proporsjonene av komponentene variere. Derfor anses elementene og forbindelsene som rene stoffer, hvis sammensetning er konstant og godt definert.
For eksempel er bordsalt eller natriumklorid en forbindelse der klor- og natriumatomer deltar, i en andel av en etter en. I mellomtiden er melk en blanding av variabel sammensetning, der hver komponent opprettholder sin identitet.
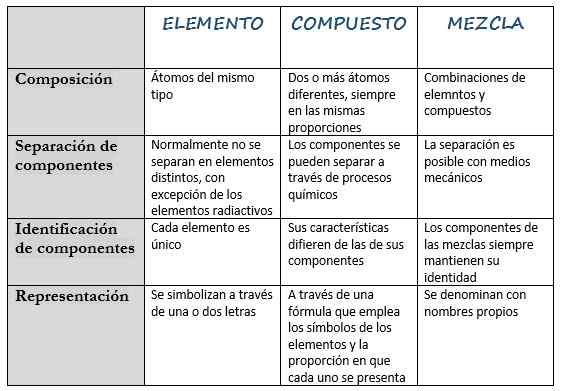
Følgende tabell samler hovedegenskapene:
Element | Forbindelse | Blande | |
Definisjon | Stoff som ikke kan dekomponeres i andre enklere stoffer. | Stoff utgjør av to eller flere forskjellige elementer. | Stoff laget når du blander andre stoffer. |
Sammensetning | Atomer av samme type. | To eller flere forskjellige atomer, alltid i samme proporsjoner. | Kombinasjoner av elementer og forbindelser. |
Komponentseparasjon | Normalt skiller de ikke seg inn i forskjellige elementer, med unntak av radioaktive elementer. | Komponenter kan skilles gjennom kjemiske prosesser. | Separasjon er mulig med mekaniske midler. |
Komponentidentifikasjon | Hvert element er unikt. | Karakteristikkene skiller seg fra komponentene. | Komponentene i blandingene holder alltid identiteten. |
Representasjon | De er symbolisert med en eller to bokstaver. | Gjennom en formel som bruker symbolene på elementene og andelen som hver og en blir presentert. | Det kalles med riktige navn. |
Eksempler | Hydrogen (H), silisium (ja), helium (HE), gull (AU), kalium (k). | Natriumklorid (NaCl), ammoniakk (NH3), natriumhydrid (NAH), nitrogendioksid (NO2). | Blod, melk, luft, sement. |
Gjenstander
Definisjon
Elementene er rene, enkle stoffer, i hvis sammensetning bare er atomer av samme type griper inn. Den kjemiske atferden til hvert element er karakteristisk og det er ingen to like, selv om det er vanlige egenskaper mellom grupper av elementer.
Kan tjene deg: iodometri: fundamenter, reaksjoner, generell prosedyre, brukDet er ikke mulig å dekomponere ett element i et enklere element, bortsett fra spesielle prosedyrer, for eksempel bombard.
Oppløsningsprosessen skjer spontant i noen stoffer som radio, visse varianter av uran, thorium og andre elementer som kalles radioaktiv.
Sammensetning
Elementene er dannet av identiske atomer. Disse består på sin side av tre typer partikler: elektroner, protoner og nøytroner. Elektroner og protoner har henholdsvis elektrisk, negativ og positiv masse. Nøytroner har masse, men ikke lastes.
Atomet består av en atomkjerne dannet av protoner og nøytroner, mens elektronene er fordelt i orbitaler rundt dem. Ett element skilles fra et annet etter antall protoner som kjernen har, kalt atomnummer.
Selv om dette forblir konstant, er det det samme elementet, selv om antallet nøytroner og elektroner endres, siden i så fall den isotoper.
Komponentidentifikasjon
Ulike og komplekse teknikker brukes, for eksempel for å "se" elektronene til atomet er det spesielle mikroskop, for eksempel tunneleffektmikroskopet.
Separasjonsteknikk
Atomet til et element skilles ikke gjennom kjemiske metoder, men bombarderes med mindre partikler, vanligvis nøytroner, i en prosess som kalles kjernefysisk fisjon. Men selv om det i teorien er fysisk, er det lettere å gjøre det med atomer som har tunge kjerner, for eksempel uran-235.
Typer elementer
Det er 118 elementer, som ligger i det periodiske tabellen, bestilt med atomnummer. Av disse finnes 92 i naturen og de gjenværende er oppnådd i laboratoriet.
Kan tjene deg: amorf karbon: hva er, typer, egenskaper, bruksområderDe er distribuert i tre grupper:
- Metaller, med frie elektroner som gjør dem til gode ledere av varme og strøm, nesten alltid fast (unntatt kvikksølv) og høy tetthet.
- Ingen metaller, mangler atferdsegenskaper, presenteres i fast eller gassformig tilstand, bortsett fra brom, og tettheten deres er lavere.
- Metalloider, elementer med mellomegenskaper mellom metaller og ikke -metaller.
Grafisk representasjon
Hvert element i det periodiske tabellen er symbolisert med bokstaver. For eksempel tilsvarer H, O, C og Fe henholdsvis hydrogen, oksygen, karbon og jern.
Eksempler på elementer
I tillegg til de nevnte, er det følgende elementer, med symbolet deres i parenteser:
- Klor (CL)
- Kvikksølv (HG)
- Fosfor (P)
- Jod (i)
- Magnesium (Mg)
Forbindelser
Definisjon
Forbindelsene er rene stoffer, hvis sammensetning to eller flere typer forskjellige atomer er involvert, i visse proporsjoner, for å danne molekyler. Fagforeninger mellom atomer utføres av lenker, som er en avgjørende faktor i de sammensatte egenskapene.
Hovedkoblingene er:
- Ionisk
- Metall
- Kovalent
Sammensetning
Forbindelsene består av to eller flere typer atomer, alltid i fast proporsjon.
Komponentidentifikasjon
Hver forbindelse har egenskaper som gjør den unik, som skiller seg fra de av dens bestanddeler, fordi de mister identiteten sin ved å danne forbindelsen. For eksempel ved romtemperatur hydrogen og oksygen er gasser, som, når de kombineres, gir opphav til vannet.
Separasjonsteknikk
Normalt er forbindelser separert ved kjemiske reaksjoner, selv om elektromagnetisk stråling, inkludert lys, også er i stand til å dissosiere molekyler.
Typer forbindelser
Forbindelsene er delt inn i to hovedkategorier:
- Uorganisk
- Organisk
Forskjellen er at organiske forbindelser er basert på karbonelementet, når det danner kovalent -type koblinger med hydrogen. Karbon deltar på samme måte i mange uorganiske forbindelser, og danner andre lenker.
Grafisk representasjon
Det gjøres gjennom sin kjemiske formel, der dens bestanddeler er spesifisert, med sitt respektive symbol og andelen de deltar. Forbindelsene har også forskjellige navn.
Eksempler på forbindelser
- Natriumklorid eller bordsalt (NaCl)
- Natriumbikarbonat (Nahco₃)
- Ammoniakk (NH3)
- Kalsiumkarbonat (Caco3)
- Glukose (c₆h₁₂o₆)
Blandinger
Definisjon
Kombinasjon av to eller flere elementer og/eller forbindelser, uten definerte proporsjoner, som hver opprettholder sin identitet, det vil si uten at egenskapene deres endrer seg når de er en del av blandingen.
Sammensetning
Det er variabelt.
Komponentidentifikasjon
Det er enklere å utføre, fordi komponentene opprettholder sin identitet.
Separasjonsteknikk
Komponentene i en blanding kan skilles ved en fysisk eller mekanisk metode, for eksempel filtrering eller sentrifugering, for eksempel.
Typer blandinger
Blandingene er klassifisert som:
- Homogen: komponentpartiklene er ikke skille ut, til tross for at de er av forskjellige stoffer. For eksempel veldig oppløst sukker i vann.
- Heterogene: blandinger der partiklene skilles ut, selv med det blotte øye, for eksempel sand og salt, eller salt blandet med metallfiler.
Grafisk representasjon
Blandingene mangler en definert formel, men mange har sine egne navn.
Eksempler på blandinger
- Sement
- Ketchup
- Tre
- Luft
- Melk
- Betong
- Blod

