Enantiomerer
- 2763
- 852
- Jonathan Carlsen
Vi forklarer hva enantiomerer og chiralitet, deres egenskaper, nomenklatur og flere eksempler er
 Disse to forbindelsene er enantiomerer, siden de er dannet av de samme atomene, forent på samme måte og er spekulære bilder av hverandre
Disse to forbindelsene er enantiomerer, siden de er dannet av de samme atomene, forent på samme måte og er spekulære bilder av hverandre Hva er enantiomerer?
De Enantiomerer De er par forbindelser som ikke er overlivbare speilbilder av hverandre. Disse parene med forbindelser er en bestemt type isomerer, det vil si at de er forskjellige forbindelser som har samme molekylformel.
Det er forskjellige typer isomerer som er stereoisomerer, der alle atomer er forent i samme rekkefølge og med samme type koblinger, men de har forskjellige orienteringer i verdensrommet (stereo betyr plass).
Innenfor stereoisomerene finner vi enantiomerer, hvis hovedkarakteristikk er å være spekulære bilder med hverandre.
Enantiomerer er veldig vanlig. Faktisk er nesten alle de organiske forbindelsene som er til stede i cellene i alle levende vesener en av to mulige enantiomerer.
For eksempel tilsvarer alle aminosyrer som er en del av naturlige proteiner enantiomeren l for den respektive aminosyren (den andre isomeren identifiserer seg med bokstav D).
På den annen side eksisterer de aktive ingrediensene i det store flertallet av medisiner også som par enantiomerer, hvorav bare en er effektiv. Vanskeligheten med å skille enantiomerer fra hverandre betyr at de medisinene som bare inneholder den nyttige isomeren er veldig dyre.
Enantiomerer og chiralitet
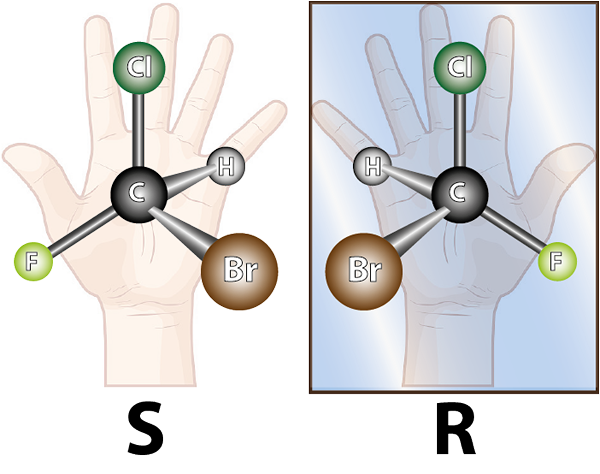
Enantiomerer dannes av chirale molekyler. Kiralitet er egenskapen til ikke å være overlappbar med sitt speilbilde. Ordet chiral kommer fra det greske begrepet, Kheir som betyr hånd, husker det faktum at hendene også er spekulære bilder av hverandre, og at de ikke kan overlappe hverandre.
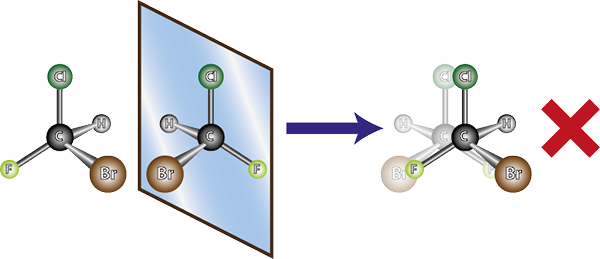 Molekylet til venstre er chiralt, siden når man sammenligner det med speilbildet, kan det sees at de ikke overlapper. Det er med andre ord ingen måte å rotere eller vri den på en slik måte at alle atomer sammenfaller med hverandre
Molekylet til venstre er chiralt, siden når man sammenligner det med speilbildet, kan det sees at de ikke overlapper. Det er med andre ord ingen måte å rotere eller vri den på en slik måte at alle atomer sammenfaller med hverandre I lys av det ovennevnte kan det trekkes ut at det for hvert chirale molekyl må være et annet chiral molekyl som ikke er det overlappende speilbildet, det vil si dets enantiomer. Med andre ord, når et molekyl sies til.
Kan tjene deg: neodym: struktur, egenskaper, brukChirale sentre
Mange chirale forbindelser har ett eller flere asymmetriske sentre som er ansvarlige for kiraliteten i molekylet. Disse kalles chirale sentre og i mange organiske forbindelser består av karbonatomer som er knyttet til 4 atomer eller grupper av forskjellige atomer.
Den spesielle formen da disse fire gruppene er fordelt rundt asymmetrisk karbon bestemmer hvilke av de to enantiomerer som tilsvarer et chiralt molekyl. Tilstedeværelsen av et enkelt quiralt senter sikrer at molekylet er chiralt, men hvis det er mer enn ett, kan det være chiral som det kanskje ikke.
Enontiomer -egenskaper
De fleste fysiske og kjemiske egenskaper er identiske
Som høyre og venstre hånd kommer enantiomerene bare parvis. Disse forbindelsene er praktisk talt identiske med hverandre. Faktisk er de fleste av dets fysiske og kjemiske egenskaper som fusjonspunktet, kokende, damptrykk og løselighet i noen løsningsmidler, blant andre, identiske.
Optisk aktivitet
Alle chirale forbindelser har en unik egenskap som skiller dem fra de som ikke er: de har evnen til å rotere planet med polarisert lys. Denne egenskapen kalles Optisk aktivitet, Og det er en av få egenskaper som skiller en chiral forbindelse fra enantiomeren.
Det siste skyldes det faktum at det polariserte lysplanet kan roteres i en av to retninger, enten i retning av klokken nåler (kalt dextrogyr og representert med +-symbolet) eller mot klokken nåler (Levógiro, representert med symbol -).
Hvis en quiral forbindelse dreier det polariserte lysplanet i en retning, vil enantiomeren vri det i motsatt retning.
-
Eksempel
En D-glukosa-løsning dreier det polariserte lysplanet i retning av klokken nåler (til høyre er det dextrogyral), mens en L-glycose-løsning får den til å rotere i motsatt retning.
Det kan tjene deg: Erlenmeyer Flask: Egenskaper, bruksområder, bruksmetoderDifferensialreaktivitet
En annen eiendom som tillater å skille den ene Enantión fra den andre, er dens reaktivitet mot andre chirale forbindelser.
Differensiell reaktivitet kan sammenlignes med måten en hanske bare ser bra ut på den ene hånden, men ikke den andre, eller som en høyre sko passer godt til høyre fot, men ikke til venstre.
En viktig konsekvens av differensialreaktivitet er de forskjellige effektene som kan forårsake de to enantiomerer av noen medisiner. Disse forskjellene kan være ufarlige, men de kan også være veldig farlige.
-
Eksempler
- Av de to enantimerne av aspartam (som er et kunstig søtstoff), er den ene søt mens den andre ikke har noen smak.
- Bare enantiomer -s av omeprazol er effektiv som gastrisk beskytter, mens den andre ikke gir noen effekt.
- D-penicilamin er et medisin mot revmatoid artritt, mens dens enantiomer, L-penicilamin er en farlig gift.
Differensiell absorpsjon
Enantiomerer skiller seg også ut i måten de blir absorbert i harpikser eller faste stoffer som også er kvitaler. En blanding av enantiomerer kan skilles hvis den føres gjennom en kolonne med chiral separasjon, siden den ene av de to enantiomerer vil bli absorbert sterkere enn den andre.
Nomenklatur av enantiomerer
Det er flere metoder for å identifisere en eller annen enantiomer, men den mest brukte er Cahn-Ingold-PRELOG (CIP) -systemet. Dette består av følgende trinn:
- Et hierarki -nivå er tildelt de fire gruppene som er knyttet til hvert chiral senter. Gruppens prioritet er tildelt i henhold til atomnummeret til atomet direkte knyttet til det quirale senteret. Hvis det er to like atomer, tilsettes atomnumrene til atomene som er koblet til de første for å legge til atomnumrene.
- Retningen som de tre prioriterte gruppene blir reist når de laveste prioriterte poengene peker tilbake blir bestemt.
- Hvis retningen på ruten er i retning av klokkehender, tildeles konfigurasjonen R, Ellers tildeles konfigurasjonen S.
Eksempel
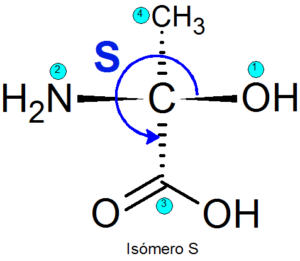
Eksempler på enantiomerer
D-glyseraldehyd og L-glyseraldehyd
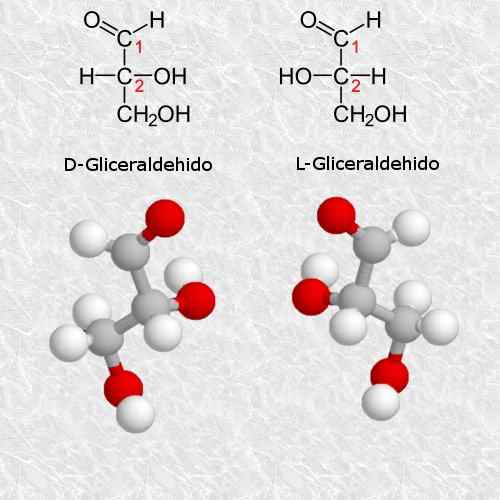
Glyceraldehyd er det enkleste og mest lille quiral karbohydratet som eksisterer, og er veldig viktig for kjemi og biologi.
I henhold til reglene for Cahn-Ingold-PRELOG-systemet, tilsvarer D-isomeren isomeren (R) og L-isomeren tilsvarer (S) (S).
D-Alanina og L-Alanina
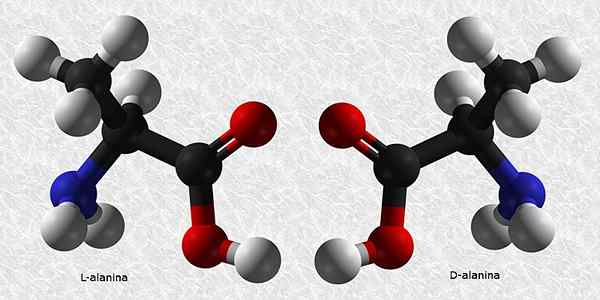
Alanin er en av de essensielle aminosyrene for konstruksjon av proteiner. Som nesten alle aminosyrer har den et chiralt karbon, så det har to enantiomerer:
Av disse to er L-Alanina den vanligste og er til stede i alle levende vesener, mens D-Alanina bare er til stede i noen bakteriecellevegger.
D-tartarisk og l-tartarsyre
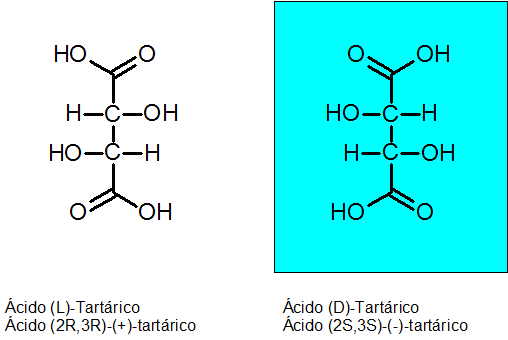
Kiraliteten ble oppdaget av Louis Pasteur i 1848 takket være tartarsyre. Denne forbindelsen har 2 asymmetriske karbonatomer og kan eksistere som to enantiomerer pluss en tredje isomer som kalles meso -forbindelse.
Den absolutte konfigurasjonen av de to chirale karbonene er r for Enantiómero Levógiro og S for Dextrogyan Enantiom.
2-butanol
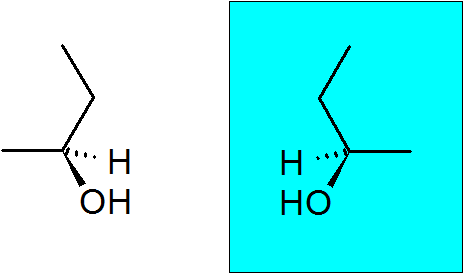
Denne alkoholen har også et quiralt karbon, som gjør at denne forbindelsen har to enantiomerer.
Bromocloroetan
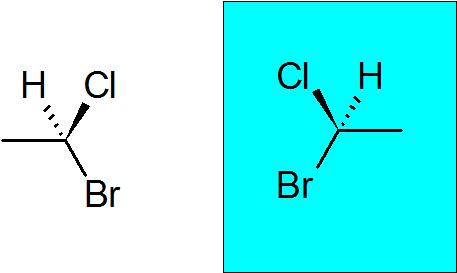
Det er en veldig enkel chiral forbindelse med bare to karbonatomer. Quiral Carbon har sluttet seg til en brom, en klor, en metyl og et hydrogen.
Referanser
- Chirality (kjemi). (18. mars 2021), på Wikipedia.com
- Carey, f. TIL. (2008). Organisk kjemi. Boston: McGraw-Hill Higher Education.
- Smith, m., Mars, j., & Mars, j. (2001). Marchs avanserte organisk kjemi: reaksjoner, mekanismer og struptur. New York: Wiley.
- M.H. Hyun (2012). 8.13 Kromatografiske separasjoner og analyse: Chiral Crowneter-baserte chirale stasjonære faser. Redaktør (er): Erick M. Carreira, Hisashi Yamamoto. Forståelse av chiralitet. Elsevier. Side 263-285. ISBN 9780080951683,
- Nguyen, l. TIL., Han, h., & Pham-huy, c. (2006). Chirale medisiner: en oversikt. International Journal of Biomedical Science: IJBS, 2(2), 85-100.

