Trippel kovalent binding
- 5059
- 1517
- Prof. Theodor Gran
Vi forklarer hva en trippelkobling er, dens egenskaper og gir flere eksempler
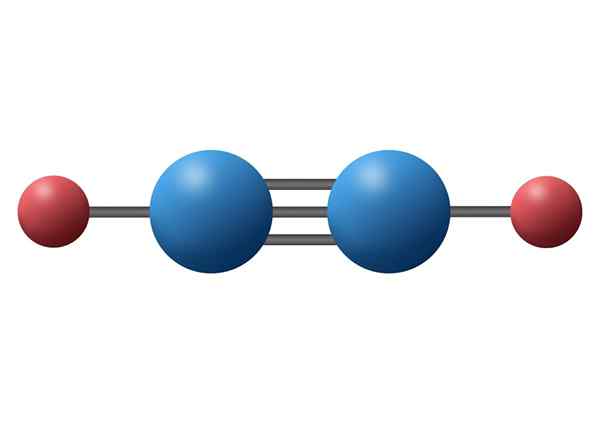 Acetylenmolekyl (C2H2) med sin trippelbinding mellom de to karbonatomene
Acetylenmolekyl (C2H2) med sin trippelbinding mellom de to karbonatomene Hva er en trippel kovalent lenke?
De Trippel kovalente bindinger De er kjemiske koblinger der to atomer deler tre par elektroner. Med andre ord, de er kovalente bindinger dannet av totalt seks valenselektroner som dreier seg om to atomer.
Det er mange kjemiske forbindelser som inneholder trippelkoblinger. For eksempel inneholder organiske forbindelser som Alkynes trippel C-C kovalente bindinger. Nitriler er også preget av å ha en gruppe som inneholder et karbon knyttet til nitrogen ved hjelp av en trippel c-n kovalent binding. Andre uorganiske forbindelser som molekylær nitrogen i luften, inneholder også trippel kovalente bindinger.
Å ha 6 elektroner som snur seg rundt to kjerner gir trippelkoblinger mange spesielle egenskaper. Både formen på molekylene som inneholder dem, og de kjemiske reaksjonene de kan delta er forskjellige fra doble eller enkle bindinger.
Trippel kovalente koblingskarakteristikker
De er dannet av 6 elektroner
Disse bindingene dannes av 6 elektroner og dannes når hvert av de to involverte atomene deler tre av sine forsvinnede elektroner med den andre. Dette er grunnen til at de kalles trippelkoblinger, siden de har tredoblet antall elektroner i den enkle kovalente bindingen.
De har en Sigma -kobling (σ) og to Pi (π) lenker
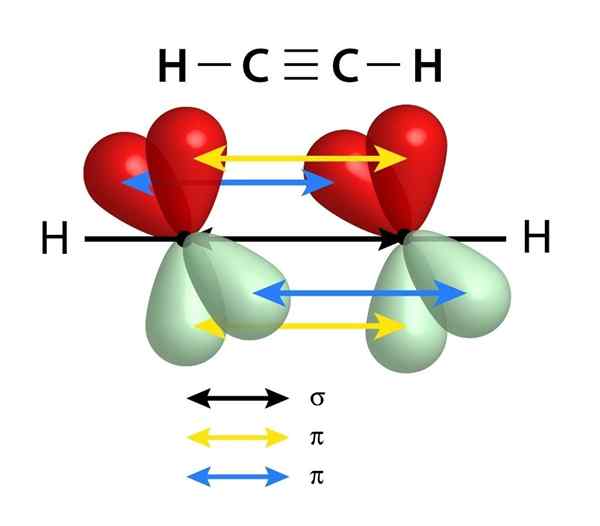 Skjema for koblingene som utgjør en trippelkobling mellom to karbonatomer. Den svarte pilen til sentrum representerer Sigma -lenken, mens de gule og blå representerer hver av de to PI -bindingene
Skjema for koblingene som utgjør en trippelkobling mellom to karbonatomer. Den svarte pilen til sentrum representerer Sigma -lenken, mens de gule og blå representerer hver av de to PI -bindingene I likhet med dobbeltbindinger dannes også trippelkoblinger av en Sigma -kobling som passerer gjennom midten av linjen som blir sammen med de to koblede atomer. I motsetning til de doble koblingene som har en, har imidlertid trippelkoblingene to PI -lenker i tillegg til Sigma -lenken.
Kan tjene deg: kobberklorid (i) (CUCL): struktur, egenskaper, brukDe danner nesten alltid lineære forbindelser
Når to karbonatomer danner en trippelkobling, har hver enkelt muligheten til å danne en ekstra enkel kobling med et annet atom (siden karbon kan danne 4 bindinger totalt).
I disse tilfellene vil både de to karbonatomer og de to andre atomene festet til dem danne en rett linje. Denne formen som molekylet skaffer seg kalles lineær geometri.
De er de sterkeste kovalente bindinger
Når du sammenligner trippelkoblingene mellom to atomer med de doble og enkle bindingene mellom de samme atomene, observeres det at trippelkoblingene alltid er sterkere enn de andre typene kovalente bindinger. Dette betyr at det er vanskeligere å bryte en trippelkobling enn en dobbel eller enkel.
Dette er fordi i tillegg å måtte bryte Sigma -lenken (som også er til stede i både enkle og dobbeltbindinger), ikke en må bryte (som i dobbeltkoblinger), men to ekstra PI -obligasjoner.
De er kortere enn dobbeltbindinger eller så enkle
På grunn av samme faktum å være sterkere koblinger, administrerer trippelkoblinger.
De representerer to umettethet
Hvert karbon som har en trippelbinding vil bare ha en ekstra kobling med et annet atom. Dette betyr at slikt karbon bare vil være koblet til to atomer, i stedet for fire, så det har mindre hydrogen enn det kunne ha hvis det bare dannet enkle bindinger.
Kan tjene deg: Heptano (C7H16): Struktur, egenskaper og brukDette kalles umettethet, og forbindelser med trippelkoblinger har to umettethet, siden hver av de to karbonatområdene vil passe til to ekstra hydrogener, hvis ikke for trippelkoblingen.
De er stive lenker
Som dobbeltbindinger er trippelkoblinger stive og vanskelige å bøye eller vri. Dette skyldes både den større koblingskraften og i laveste lengde.
De kan fungere som baser
Noen forbindelser med trippelkoblinger kan bruke PI -elektronene til nevnte lenke for å koble eller akseptere H -ioner+, Derfor fungerer som baser.
De kan hydrogen dem for å gi doble eller enkle lenker
Umettetheten av trippelkoblingen kan fjernes ved å bryte PI -bindingene og legge hydrogener til de to karbonatområdene. Dette kalles hydrogenering. Hvis bare et hydrogenmolekyl til en trippelbinding tilsettes, vil det bli en dobbeltbinding. Hvis to hydrogenmolekyler tilsettes, vil det bli en enkel binding.
Eksempler på trippel kovalente lenker
Nitrogenmolekyl (n2)
Nitrogenmolekylet inneholder en trippel kovalent binding mellom de to nitrogenatomene. Hvert atom deler sine tre valenselektroner forsvant med den andre, og hvert nye par elektroner blir Sigma -bindingen eller en av de to PI -bindingene som molekylet har.
 Nitrogenmolekyl
Nitrogenmolekyl I dette tilfellet parer både de to nitrogenatomer og de uskadd elektronene som hver av dem ligger langs en rett linje.
Riktig (en alkyne av formel c3H4)
Riktig er den nest enkleste alkyne som eksisterer. Denne forbindelsen består av en tre -karbonkjede, hvorav to er koblet gjennom en trippel kovalent lenke.
Kan tjene deg: umettede hydrokarboner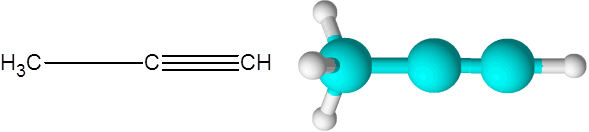 Propino -molekyl
Propino -molekyl Her kan du også se at de tre karbonatområdene og det siste hydrogenatomet (den til høyre) danner en rett linje. I modellen kan det også sees at den enkle C-C-koblingen er lengre enn Triple C-C-lenken.
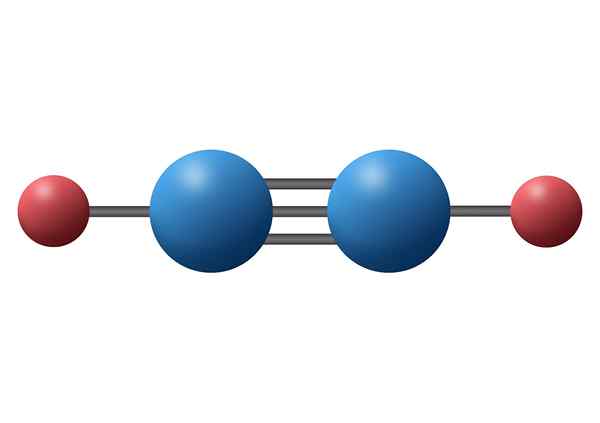
Karbonmonoksid (CO)
Karbonmonoksid er en giftig uorganisk gass som har et negativt karbonatom og positivt oksygen koblet ved hjelp av en trippel kovalent binding. I dette tilfellet er det en polarbinding, på grunn av forskjellen i elektronegativiteter mellom karbon og oksygen.
 Karbonmonoksidmolekyl
Karbonmonoksidmolekyl

