PI -lenke
- 4197
- 895
- Dr. Andreas Hopland
Vi forklarer hva PI -lenken er, hvordan dens egenskaper dannes, og vi gir flere eksempler
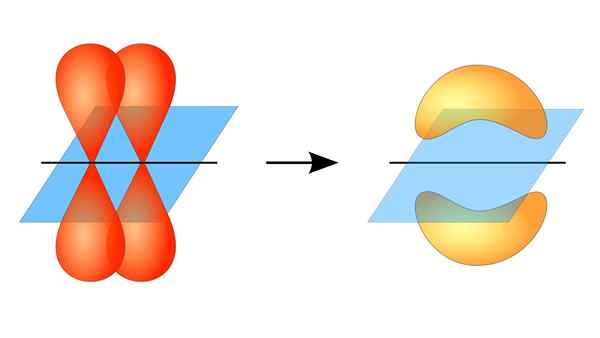
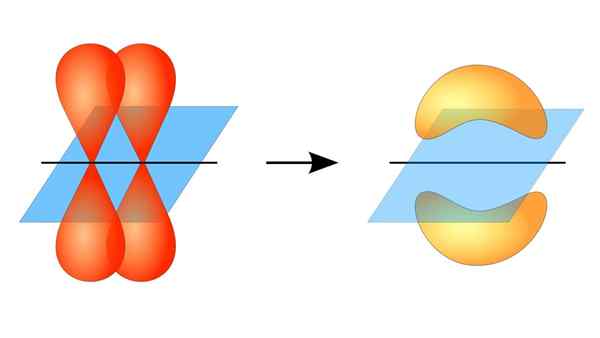 To orbitaler p danner en kobling π
To orbitaler p danner en kobling π Hva er en PI -lenke?
EN PI -lenke (π) Det er en kovalent type kobling som er karakterisert ved å forhindre den frie rotasjonsbevegelsen av atomer og opprinnelse mellom et par rene atombaner, blant andre særegenheter. Det er koblinger som kan dannes mellom atomer av elektronene deres, som lar dem bygge større og mer komplekse strukturer: molekyler.
Disse koblingene kan være av forskjellige varianter, men de vanligste i dette studieretningen er de kovalente. De kovalente bindinger, også kalt molekylær, er en type kobling der atomene som er involvert deler elektronpar.
Dette kan oppstå på grunn av behovet for atomer for å søke stabilitet, og dermed danne de fleste forbindelsene som er kjent. I denne forstand kan kovalente bindinger være enkle, doble eller trippel, avhengig av konfigurasjonen av deres orbitaler og mengden elektronpar som deles mellom atomene som er involvert.
Dette er grunnen til at det er to typer kovalente bindinger som dannes mellom atomer basert på orienteringen til deres orbitaler: Sigma (σ) koblinger og Pi (π) lenker (π).
Det er viktig å skille begge koblingene, ettersom Sigma -koblingen blir presentert i enkle fagforeninger og PI i flere fagforeninger mellom atomer (to eller flere elektroner deles).
Hvordan er PI -koblingsskjemaene?
For å beskrive dannelsen av PI -lenken, bør den først diskuteres om hybridiseringsprosessen, da den griper inn i noen viktige koblinger.
Hybridisering er en prosess der hybrid elektroniske orbitaler dannes; det vil si der atomiske under -nivåer s og p kan blandes. Dette forårsaker dannelse av SP, SP orbitals2 og sp3, som kalles hybrider.
Kan tjene deg: Reversibel reaksjon: Kjennetegn og eksemplerI denne forstand oppstår dannelsen av PI -koblingene takket være overlappingen av et par lober som tilhører et atomisk orbital på et annet par lober som er i en orbital som er en del av et annet atom.
Denne orbital overlappingen skjer sideveis, så den elektroniske fordelingen er konsentrert for det meste over og under planet som danner de koblede atomkjernene, og får PI -bindinger til å være svakere enn Sigma -bindinger.
Når du snakker om orbital symmetri av denne typen union, skal det nevnes at den er lik den for p orbitals type p så lenge den blir observert gjennom aksen dannet av lenken. I tillegg er disse fagforeningene stort sett konstituert av orbitaler p.
PI -bindingsdannelse i forskjellige kjemiske arter
Ettersom PI -bindingene alltid er ledsaget av en eller to lenker til (en Sigma eller en annen PI og en Sigma), er det relevant å vite at dobbeltbindingen som dannes mellom to karbonatomer (konstituert av en Sigma -binding og en PI) har lavere koblingsenergi enn den som tilsvarer det dobbelte av Sigma -koblingen mellom de to.
Dette forklares med stabiliteten til Sigma -lenken, som er større enn PI -bindingen fordi overlappingen av atombaner i sistnevnte skjer parallelt i regionene over og under lobene, og akkumulerer elektronisk fordeling på en videre måte atomisk atomisk Kjerner.
Til tross for dette, når PI- og Sigma -koblinger kombineres en flere høyere koblinger enn den enkle koblingen i seg selv, som kan verifiseres ved å observere koblingslengdene mellom forskjellige atomer med enkle og flere koblinger.
Kan tjene deg: ikke -metalliske oksiderDet er noen kjemiske arter som studeres ved deres eksepsjonelle oppførsel, for eksempel koordinasjonsforbindelser med metallelementer, der de sentrale atomene bare er forent av PI -bindinger.
PI -koblingskarakteristikker
Tillater ikke den frie rotasjonsbevegelsen av atomer
Karakteristikkene som skiller PI -koblingene fra andre typer interaksjoner mellom atomarter er beskrevet nedenfor, og starter med at denne foreningen ikke tillater den frie rotasjonsbevegelsen av atomer, for eksempel karbon. Av denne grunn, hvis det er en rotasjon av atomene, oppstår bindingsbruddet.
Overlapp mellom orbitaler av to parallelle regioner
På samme måte skjer overlappingen mellom orbitalene i disse koblingene gjennom to parallelle regioner, noe som gjør at de har en større diffusjon enn Sigma -bindingene, og at de av denne grunn er svakere.
Mellom et par rene atombaner
På den annen side, som nevnt ovenfor, genereres PI -koblingen alltid blant et par rene atombaner; Dette betyr at det genereres mellom orbitaler som ikke har fått hybridiseringsprosesser, der tettheten av elektroner stort sett er konsentrert over og under planet dannet av den kovalente union.
I denne forstand kan mer enn en PI -kobling presenteres blant et par atomer, og alltid bli ledsaget av en Sigma -kobling (i dobbeltbindinger).

Tilsvarende kan du gi en trippelkobling mellom to tilstøtende atomer, som er dannet av to PI -bindinger i posisjoner som danner vinkelrett plan med hverandre og en Sigma -kobling mellom de to atomene.
Kan tjene deg: huminsyre: struktur, egenskaper, innhenting, brukEksempler på PI -lenker
Etylenmolekyl
Som tidligere nevnt, har molekylene som er sammensatt av forente atomer av en eller flere PI -bindinger alltid flere koblinger; det vil si dobbelt eller trippel.
Et eksempel på dette er etylenmolekylet (h2C = Ch2), som utgjøres av en dobbel union; Det vil si en PI og en sigma -binding mellom karbonatomene, i tillegg til sigma -bindinger mellom karbonatomer og hydrogener.
Acetylenmolekyl
For sin del har acetylenmolekylet (H-C≡C-H) en trippelkobling mellom karbonatomene; Det vil si at to PI-bindinger som danner vinkelrett plan og en sigma-binding, i tillegg til tilsvarende karbon-hydrogenbindinger.
Benzen og derivater
PI -bindinger mellom sykliske molekyler presenteres også, for eksempel benzen (C6H6) og dets derivater, hvis disposisjon resulterer i en effekt som kalles resonans, som gjør at elektronisk tetthet kan migrere mellom atomer og bevilgning, blant annet større stabilitet til forbindelsen.
Dikarbon
For å eksemplifisere de tidligere nevnte unntakene, har tilfellene av det dikarbonale molekylet (C = C, der begge atomene har et par sammenkoblede elektroner) og koordinasjonsforbindelsen kalt heksacarbonildihierro (representert som tro2(CO)6, som bare dannes av Pi -lenker mellom atomene).

