Væskedampbalanse

- 2613
- 162
- Mathias Aas
Hva er væskedampbalanse?
Han væskedampbalanse Det er en dynamisk tilstand som etablerer en væske, det være seg et rent stoff eller en blanding, med dampen som omgir og samhandler med overflaten. For å finne sted må beholderen være lukket, ellers vil luftstrømmene føre til at væsken fordamper sakte.
Når systemet er lukket, vil trykket utøvd av dampfasemolekyler klatre etter hvert som tiden går. Et poeng vil komme der presset vil stoppe; Dette er væskens damptrykk, som er en fysisk egenskap av saken, og er uavhengig av størrelsen på beholderen, eller væskevolumet.
 Når en gasdrikk blir avdekket, forstyrres dens væskedampbalanse, noe som forårsaker en ubalanse i trykket utenfor og inne i flasken, og med den bubb. Kilde: Openstax, CC av 4.0, via Wikimedia Commons
Når en gasdrikk blir avdekket, forstyrres dens væskedampbalanse, noe som forårsaker en ubalanse i trykket utenfor og inne i flasken, og med den bubb. Kilde: Openstax, CC av 4.0, via Wikimedia Commons Hver væske, ren eller blandet, vil ha et tilhørende damptrykk som vil avhenge av volatiliteten til komponentene; Og derfor av de intermolekylære kreftene som holder dem sammen i væsken og på overflaten.
Dette trykket kan beskrives ved å anta løsningene til løsningene, eller blandbarheten av komponentene i en blanding. For å gjøre dette er bruken av binære diagrammer veldig nyttig, der det er mulig å tenke på levedyktigheten til en separasjonsprosess.
Væskedamper-likevekten er avgjørende for uendelig av kjemisk ingeniørprosesser, for eksempel brøkdestillasjoner og de som er laget med vanndamp, som destilleres destillert i de mest flyktige komponentene oppnås. Dette er tilfelle av etanol på 95.4% i vann, og er den mest tilgjengelige og økonomiske alkoholprosenten i markedet.
Rene stoffer
Molekylene i et rent stoff er ikke stille, men flytt fra et sted til et annet takket være en iboende kinetisk energi. Denne energien kan noen ganger være stor nok til å overvinne de intermolekylære kreftene som "trekker" et molekyl fra spesielt til væskens barm. Deretter vil molekylet rømme fra overflaten av væsken til dampfasen.
I dampfasen vil molekylene kollidere med de indre veggene i beholderen, vinne eller miste hastigheten til de gjenforenes med overflaten på væsken, hvor når de først er å integrere konglomeratet til molekyler i væskefasen.
Kan tjene deg: kobolt: struktur, egenskaper, applikasjonerDermed går tiden til, ved en viss temperatur (for å si 25 ° C), antall molekyler som unnslipper overflaten, tilsvarer de som kommer fra damp. Det sies derfor at det er etablert en væskedampbalanse i et rent stoff til.
Damptrykket for å oppleve de indre veggene i beholderen, så vel som overflaten på væsken, vil være lik PTILº, som er konstant og reproduserbar; Uavhengig av hvor stor eller liten beholderen er heller ikke volumet på væsken som skal vurderes.
Blandinger
I flytende blandinger vil det også være en komponent som utøver trykk på væskeoverflaten og beholderkonturene. Ditt damptrykk, som forventet, vil være sammensatt av bidrag fra hver av komponentene i blandingen, for å si, to stoffer A og B. Disse blandingene kan være blandbare, delvis blandbare.
Blandbare
I en blandbar blanding mellom A og B utgjør begge stoffene en enkelt fase, som ved første øyekast ser ut som et rent stoff. I henhold til Daltons lov vil således trykket fra blandingen eller løsningen være lik:
Psol = STIL + PB +··· pYo
Å være sYo Enhver annen komponent som også er til stede i blandingen. Merk at sTIL≠ PTILº, det vil si at presset av stoffene i blandingen ikke er det samme som for deres høye renhetstilstander.
Når du antar at løsningen er ideell, er forskjellene mellom interaksjoner A-A, B-B og A-B åpenbare. Dette kan for eksempel brukes i en blanding av etanol og metanol.
Derfor vil damptrykket til komponentene i blandingen avhenge av deres relative mengder i væskefasen, uttrykt som molære fraksjoner xYo. Og det er her Raaults lov griper inn, som søker å relatere presset PTIL Og sTILº:
PTIL = XTIL PTILº
Å nå det totale trykket lik:
Psol = XTIL PTILº + xB PBº +···
Dampfasen, derimot, vil ha sine egne komposisjoner, uttrykt som Yi molar fraksjoner:
Yi = sYo / Ssol
= XYo PYoº / ssol
Binært diagram
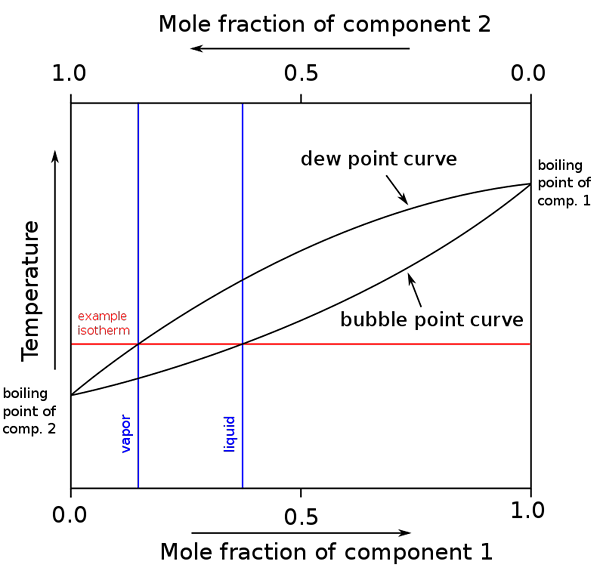 Diagram over kokepunkter og molære sammensetninger for en binær blanding. Kilde: binary_boiling_point_diagram.PNG: H Padleckasderivative Work: Michbich, CC By-SA 2.5, via Wikimedia Commons
Diagram over kokepunkter og molære sammensetninger for en binær blanding. Kilde: binary_boiling_point_diagram.PNG: H Padleckasderivative Work: Michbich, CC By-SA 2.5, via Wikimedia Commons Når de molære fraksjonene av komponentene i en binær blanding (A + B) er grafisk, avhengig av temperatur eller trykk, oppnås binære diagrammer (se over). Denne spesielle formen, den enkleste, tilsvarer den for ideelle løsninger.
Kan tjene deg: molært volum: konsept og formel, beregning og eksemplerOmrådet over "oval" tilsvarer dampfasen, mens området nedenfor tilsvarer den væskefasen av blandingen. Merk at når den molære fraksjonen av komponent 1 eller er 0 (x1= 0), vil den molære fraksjonen av komponent 2 eller B være lik 1 (x2= 1), og da skylder damptrykket bare b. Denne temperaturen blir kokepunktet til B.
I mellomtiden, i den andre enden (til høyre), når x2= 0 men x1= 1, damptrykket er bare. Denne temperaturen blir den for kokepunktet.
Den nedre ovale linjen tilsvarer boblepunktet, som er når den første boblen vises når væskeblandingen er oppvarmet (går opp i diagrammet). Og den øvre linjen tilsvarer duggpunktet, som er når dampfasen avkjøles og den første dråpen vises (går ned i diagrammet).
Azeotropos
I mange ikke -ideale løsninger vil vi ha azeotrops, som er blandinger som fordamper opprettholdelsen av sammensetningen konstant; det vil si at de fordamper som om de var en ren forbindelse.
Det er umulig å "bryte" en azeotropisk sammensetning gjennom mer destillasjonstrinn. I stedet brukes andre metoder for å øke renheten til ønsket komponent.
For eksempel danner etanol-vann-blandingen en azeotropisk med en 95-komposisjon.4 av etanol. Dette betyr at det er umulig, gjennom destillasjoner, å oppnå en etanol med en konsentrasjon større enn 95.4%; Det vil alltid være 4.6% gjenværende vann. Hvis du ønsket å tilberede absolutt etanol (100%), ville det være nødvendig å bruke dehydreringsmaterialer, eller andre synteseuter.
I et binært diagram kan vi se tilstedeværelsen av en azeotrope, som presenterer følgende form:
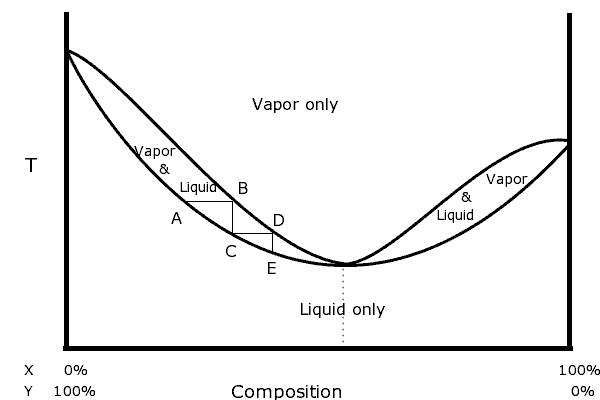 Binært diagram over en blanding med positiv azeotropisk. Kilde: Karlhahn på engelsk Wikipedia, Public Domain, via Wikimedia Common
Binært diagram over en blanding med positiv azeotropisk. Kilde: Karlhahn på engelsk Wikipedia, Public Domain, via Wikimedia Common Til venstre for diagrammet kan det sees at vi innenfor det "ovale", et område der vi har væskedampbalansen, kan vi destillere i påfølgende trinn (A, B, C, D og E) for å oppnå en stadig mer rik blanding i den mest flyktige komponenten (x for dette diagrammet).
I det azeotropiske punktet er imidlertid x og y og kokeblandingen som om det var et enkelt stoff, så det spiller ingen rolle hvor mange destillasjoner som er laget, både væsken og dampen vil ha samme sammensetning.
Kan tjene deg: Molekylær formel: Hvordan få det ut, eksempler og øvelserDelvis blandbar
I de delvis blandbare blandingene vil de bli dannet, avhengig av temperaturen, to gjenkjennelige faser: en rik på komponent A, og en annen rik på komponent B. De binære diagrammer for disse tilfellene er mange strengere og brede, siden de involverer regioner der dampkoeksister sammen med de to fasene.
Uhvans
Når du snakker om uønskelige blandinger, vil hver komponent oppføre seg som om den var i en tilstand av høy renhet, siden den knapt samhandler med de andre molekylene. Derfor vil damptrykket for disse blandingene være lik:
Psol = STILº + sBº +··· PYoº
Blandingen vil koke ved en temperatur som er lavere enn for rene komponenter, fordi trykket til den uønskelige blandingen vil være høyere, siden den er lik summen av trykket til hver komponent i sin rene tilstand. Mer damptrykk innebærer at det er mer flyktig, og derfor vil koke ved lavere temperatur.
applikasjoner
Destillasjoner
I destillasjoner, spesielt på industrielt nivå, er kunnskap om væskedampbalanse primær. Fra komponentene i blandingen, og dets fasediagrammer, kan det beregnes hvor mange retter som trengs i konstruksjonen av et fraksjonstårn for riktig separasjon av nevnte komponenter.
Vanndampdestillasjon
Vanndamp kan pumpes inne i en blanding under destillasjon. Når du boblende vanndamp inne i væsken, vil damptrykket til blandingen bli økt, så den vil koke ved en lavere temperatur og bidra til å trekke ut de mest flyktige komponentene (for eksempel essenser).
Drikker fugl
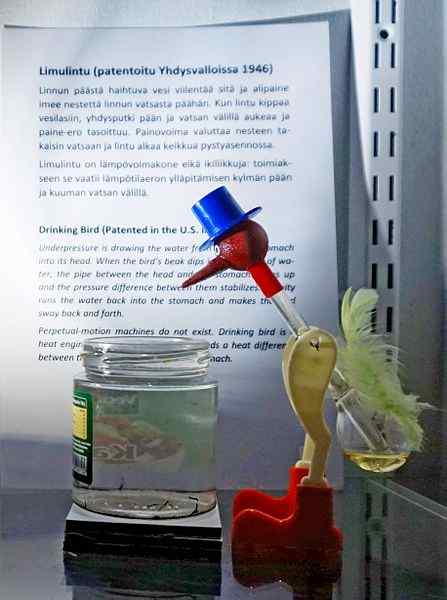 Drikker fugl, en av de mest geniale lekene gjennom tidene. Kilde: Tiia Monto, CC BY-SA 4.0, via Wikimedia Commons
Drikker fugl, en av de mest geniale lekene gjennom tidene. Kilde: Tiia Monto, CC BY-SA 4.0, via Wikimedia Commons Selv om det ikke er nettopp en likevekt av væskedamper, er sannheten at bak driften av den drikkefuglen er flere termodynamiske fenomener skjult.
Når fuglens hode er vått, begynner det å avkjøles når vannet fordamper. Denne temperaturnedgangen forårsaker en reduksjon i trykk inne i fuglens hode. Metylenkloridet, som ligger ved fuglenes bunn, vil søke å balansere trykket og strømme opp gjennom et glassrør som forbinder hodet med hodet.
Væsken vil stige til fuglens hode, gjøre det tyngre og vippe kroppen fremover. Fuglen så "drikke vann" og damptrykk vil balansere. Balansere presset, fuglenes fugl vil vende tilbake til den vertikale posisjonen og syklusen vil bli gjentatt mens vannet i hodet fordamper igjen.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Walter J. Moore. (1962). Fysisk kjemi. (Fjerde utgave). Longmans.
- Wikipedia. (2020). Damp-væske-likevekt. Hentet fra: i.Wikipedia.org
- Ed Vitz et al. (5. november 2020). Damp-væske-likevekt. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Limer Eric. (30. januar 2018). En absurd detaljert forklaring av det drikke fugle leketøyet. Gjenopprettet fra: Popularmechanics.com
- University of Alicante. (s.F.). Emne 4: Beregning av balansedamp. Likevektsdiagrammer. [PDF]. Gjenopprettet fra: Rua.Ua.er

