Lewis Structure hva den består av, hvordan det gjøres, eksempler

- 4495
- 107
- Prof. Joakim Johansen
De Lewis -struktur Det er alt det representasjonen av kovalente bindinger i et molekyl eller et ion. I den er disse bindingene og elektronene representert med lange punkter eller skript, selv om mesteparten av tiden tilsvarer punktene de ikke delte elektronene og skriptene til de kovalente bindingene.
Men hva er en kovalent lenke? Det er deling av et par elektroner (eller punkter) mellom to atomer i det periodiske tabellen. Med disse diagrammer kan du tegne mange skjeletter for en viss forbindelse. Hvilken av dem er den rette vil avhenge av de formelle belastningene og den kjemiske naturen til de samme atomene.
 2-bromopropanforbindelse. Av Ben Million [Public Domain], fra Wikimedia Commons.
2-bromopropanforbindelse. Av Ben Million [Public Domain], fra Wikimedia Commons. I det overlegne bildet er det et eksempel på hva en Lewis -struktur er. I dette tilfellet er forbindelsen som er representert 2-bromopropano. De svarte punktene som tilsvarer elektronene kan sees, både de som deltar i koblingene og de som ikke er delt (det eneste dreiemomentet rett over BR).
Hvis poengene med poeng ":" ble erstattet av et langt manus "-", ville karbonskjelettet til 2-bromopropano bli representert som: C-C-C-C. Hvorfor i stedet for den "molekylære rammen" tegnet, kan det være C-H-C-C? Svaret ligger i de elektroniske egenskapene til hvert atom.
Fordi hydrogen bare har ett elektron og en enkelt orbital tilgjengelig for å fylle, bare en kovalent binding. Derfor kan du aldri danne to bindinger (ikke forveksle med hydrogenbroer). På den annen side tillater den elektroniske konfigurasjonen av karbonatomet (og krever) dannelsen av fire kovalente bindinger.
Av den grunn må Lewis strukturer der C og H være konsistente og respektere det som styres av deres elektroniske konfigurasjoner. På denne måten, hvis karbon har mer enn fire bindinger, eller hydrogen mer enn ett, kan skissen utelukkes og starte en ny mer i tråd med virkeligheten.
Det er her noen av de viktigste årsakene eller ryggen til disse strukturene vises, introdusert av Gilbert Newton Lewis i deres søk etter molekylære representasjoner som er trofaste mot eksperimentelle data: molekylstrukturen og formelle belastninger.
Alle eksisterende forbindelser kan være representert av Lewis -strukturer, og gir en første tilnærming til hvordan molekylet eller ionene kan være.
[TOC]
Hva er Lewis struktur?
Det er en representativ struktur av Valencia -elektroner og kovalente bindinger i et molekyl eller ion som tjener til å ha en ide om molekylstrukturen.
Imidlertid klarer ikke denne strukturen å forutsi noen viktige detaljer som molekylær geometri med hensyn til et atom og omgivelsene (hvis det er firkantet, flatt, bipiramidal osv.).
Det sier ikke noe angående hva som er den kjemiske hybridiseringen av atomene, men hvor dobler eller trippelbindinger er plassert og om det er resonans i strukturen.
Med denne informasjonen kan du krangle om reaktiviteten til en forbindelse, dens stabilitet, hvordan og hvilken mekanisme molekylet vil følge når du reagerer.
Av denne grunn slutter Lewis strukturer aldri å bli vurdert og er veldig nyttige, fordi de kan kondensere ny kjemisk læring.
Hvordan gjøres det?
For å tegne eller tegne en struktur, formel eller Lewis -diagram, er den kjemiske formelen til forbindelsen viktig. Uten det kan du ikke en gang vite hva som er atomene som utgjør det. En gang med den brukes den periodiske tabellen til å lokalisere hvilke grupper som hører hjemme.
Kan tjene deg: viskositet: eksempler, årsaker, enheter, typerFor eksempel, hvis du har forbindelse C14ENTEN2N3 Da må vi se etter gruppene der karbon, oksygen og nitrogen er. Gjort dette, uavhengig av forbindelsen, forblir antall valenselektroner det samme, så før eller senere husker de.
Dermed tilhører karbon momsgruppen, oksygen til Via -gruppen og nitrogen til VA. Gruppenummeret er lik mengden elektron (poeng) av Valencia. Alle av dem har til felles tendensen til å fullføre oktetten til Valencia -laget.
Hva er oktettregelen?
Dette sier at det er en trend med atomer for å fullføre energinivået med åtte elektroner for å oppnå stabilitet. Dette gjelder alle ikke -metalliske elementer eller de som finnes i blokker S eller P for periodisk tabell.
Imidlertid adlyder ikke alle elementer oktettregelen. Spesielle tilfeller er overgangsmetaller, hvis strukturer er mer basert på formelle belastninger og deres gruppenummer.
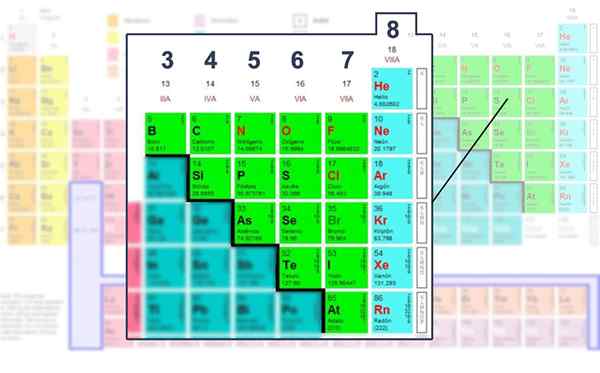 Antall elektroner i Valencia -laget av de ikke -metalliske elementene, de der det kan betjenes med Lewis -strukturen.
Antall elektroner i Valencia -laget av de ikke -metalliske elementene, de der det kan betjenes med Lewis -strukturen. Bruke den matematiske formelen
Når du vet hvilken gruppe elementene tilhører, og derfor er antall valenselektroner som er tilgjengelige for å danne koblinger, følgende formel laget, noe som er nyttig for å tegne Lewis strukturer:
C = n - d
Hvor C betyr delte elektroner, det vil si de som deltar i de kovalente båndene. Ettersom hver lenke består av to elektroner, er C/2 lik antall koblinger (eller skript) som må trekkes.
N er nødvendige elektroner, De som må ha atomet i sitt Valencia -lag for å være isolektronisk mot den edle gassen som følger i samme periode. For alle andre elementer enn H (siden det krever to elektroner for å sammenligne med han) trenger de åtte elektroner.
D er Tilgjengelige elektroner, som bestemmes av gruppen eller elektronene antall Valencia. Når CL tilhører gruppe VIIA, må den være omgitt av syv svarte eller elektroner, og husk at et par er nødvendig for å danne en lenke.
Å ha atomene, poengene deres og antall koblinger c/2, en Lewis -struktur kan deretter improvisiseres. Men i tillegg er det nødvendig å ha forestilling om andre "regler".
Hvor du kan plassere de mindre elektronegative atomer
De mindre elektronegative atomer i de aller fleste strukturer okkuperer sentrene. Av denne grunn, hvis du har en forbindelse med atomer av P, O og F, må P derfor være i midten av den hypotetiske strukturen.
Det er også viktig å fremheve at hydrogener vanligvis er knyttet til veldig elektronegative atomer. Hvis du har i en Zn-, H- og O-forbindelse, vil H gå ved siden av O og ikke med Zn (Zn-O-H og No H-Zn-O). Det er unntak fra denne regelen, men forekommer vanligvis med ikke -metalliske atomer.
Symmetri og formell belastning
Naturen har en høy preferanse for å forårsake molekylære strukturer så symmetrisk som mulig. Dette hjelper til med å unngå å heve uordnede strukturer, med atomene anordnet på en slik måte at de ikke overholder noe tydelig mønster.
Det kan tjene deg: Acid-Bass Theories: Arrhenius, Bronsted-Lowry, LewisFor eksempel for forbindelse C2TIL3, Der A er et fiktivt atom, vil den mest sannsynlige strukturen være A-C-A-C-A. Legg merke til symmetrien fra sidene, begge refleksjonene til den andre.
Formelle belastninger spiller også en viktig rolle når du tegner Lewis strukturer, spesielt for ioner. Dermed kan koblinger legges til eller fjernes slik at den formelle belastningen til et atom tilsvarer den totale belastningen som vises. Dette kriteriet er veldig nyttig for overgangsmetallforbindelser.
Begrensninger i oktettregelen
 Aluminium trifluoridrepresentasjon, en forbindelse som er ustabil. Begge elementene består av seks elektroner, som genererer tre kovalente bindinger, når de skal være åtte for å oppnå stabilitet. Kilde: Gabriel Bolívar
Aluminium trifluoridrepresentasjon, en forbindelse som er ustabil. Begge elementene består av seks elektroner, som genererer tre kovalente bindinger, når de skal være åtte for å oppnå stabilitet. Kilde: Gabriel Bolívar Ikke alle regler er oppfylt, noe som ikke nødvendigvis betyr at strukturen er feil. Typiske eksempler på dette er observert i mange forbindelser der elementer i gruppe IIIA (B, Al, GA, IN, TL) er involvert. Her er spesielt ansett som aluminium trifluoruro (ALF3).
Deretter bruker formelen beskrevet ovenfor, har du:
D = 1 × 3 (et aluminiumatom) + 7 × 3 (tre fluoratomer) = 24 elektroner
Her på 3 og 7 er de respektive gruppene eller antall valenselektroner tilgjengelig for aluminium og fluor. Deretter vurderer de nødvendige elektronene n:
N = 8 × 1 (et aluminiumatom) + 8 × 3 (tre fluoratomer) = 32 elektroner
Og derfor er de delte elektronene:
C = n - d
C = 32 - 24 = 8 elektroner
C/2 = 4 lenker
Siden aluminium er det minst elektronegative atomet, må det plasseres i sentrum, og fluoren danner bare en kobling. Med tanke på dette har du Lewis del Alf -strukturen3 (Øvre bilde). Delte elektroner blir fremhevet med grønne punkter for å skille dem fra de ukomparerte.
Selv om beregningene spår at det er 4 koblinger som må dannes, mangler aluminium tilstrekkelige elektroner, og det er heller ikke noe fjerde fluoratom. Som et resultat overholder ikke aluminium oktettregelen, og dette faktum gjenspeiles ikke i beregningene.
Lewis strukturer eksempler
Jod
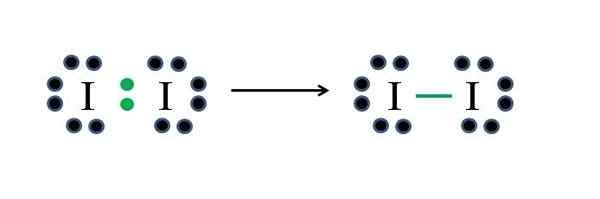 Iodo ikke -metaller har syv elektroner hver, så ved å dele en av disse elektronene hver, genererer de en kovalent binding som gir dem stabilitet. Kilde: Gabriel Bolívar
Iodo ikke -metaller har syv elektroner hver, så ved å dele en av disse elektronene hver, genererer de en kovalent binding som gir dem stabilitet. Kilde: Gabriel Bolívar Jod er et halogen og tilhører derfor gruppe VIIA. Den har da syv elektroner av Valencia, og dette enkle diatomiske molekylet kan representeres improvisere eller påføring av formelen:
D = 2 × 7 (to jodatomer) = 14 elektroner
N = 2 × 8 = 16 elektroner
C = 16 - 14 = 2 elektroner
C/2 = 1 lenke
Ettersom 14 elektroner 2 deltar i den kovalente bindingen (grønne punkter og skript), forblir 12 som ikke delt; Og fordi de er to jodatomer, må 6 distribueres for en av dem (deres valenselektroner). I dette molekylet er bare denne strukturen mulig, hvis geometri er lineær.
Ammoniakk
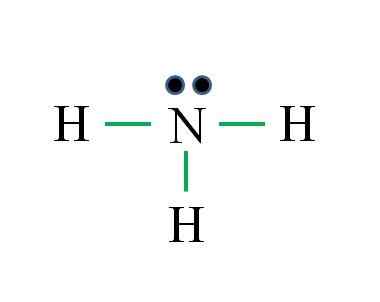 Nitrogen har 5 elektroner, mens hydrogen bare 1. Tilstrekkelig for å oppnå stabilitet når tre kovalente bindinger er etablert, sammensatt av et elektron av N og en annen av H -kilde: Gabriel Bolívar
Nitrogen har 5 elektroner, mens hydrogen bare 1. Tilstrekkelig for å oppnå stabilitet når tre kovalente bindinger er etablert, sammensatt av et elektron av N og en annen av H -kilde: Gabriel Bolívar Hva er Lewis struktur for ammoniakkmolekyl? Siden nitrogen er fra VA -gruppen, har det fem elektroner av Valencia, og deretter:
Det kan tjene deg: Laboratorytermometer: Kjennetegn, hva er det for, bruk, eksemplerD = 1 × 5 (et nitrogenatom) + 1 × 3 (tre hydrogenatomer) = 8 elektroner
N = 8 × 1 + 2 × 3 = 14 elektroner
C = 14 - 8 = 6 elektroner
C/2 = 3 lenker
Denne gangen er formelen riktig med antall lenker (tre grønne lenker). Fra de 8 tilgjengelige elektronene 6 deltar i bindingene, er det et ikke -delt dreiemoment som ligger over nitrogenatom.
Denne strukturen sier alt som skal være kjent fra ammoniakkbasen. Ved å bruke kunnskapen om TEV og TRPEV, følger det at geometri er tetrahedral forvrengt av det frie nitrogenmomentet og at hybridiseringen av dette derfor er SP3.
C2H6ENTEN
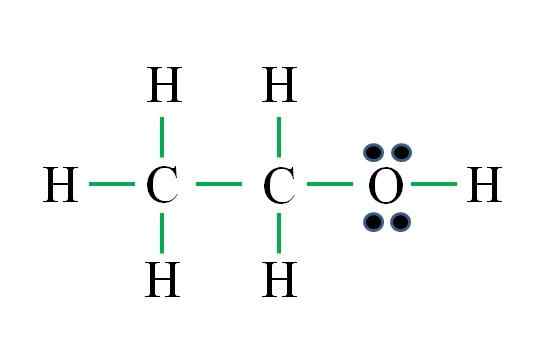 Kilde: Gabriel Bolívar
Kilde: Gabriel Bolívar Formelen tilsvarer en organisk forbindelse. Før du bruker formelen, må det huskes at hydrogener danner en enkelt binding, oksygen to, karbon fire og at strukturen må være så symmetrisk som mulig. Fortsetter som de tidligere eksemplene er:
D = 6 × 1 (seks hydrogenatomer) + 6 × 1 (et oksygenatom) + 4 × 2 (to karbonatomer) = 20 elektroner
N = 6 × 2 (seks hydrogenatomer) + 8 × 1 (et oksygenatom) + 8 × 2 (to karbonatomer) = 36 elektroner
C = 36 - 20 = 16 elektroner
C/2 = 8 lenker
Antall grønne skript tilsvarer de 8 beregnede koblingene. Den foreslåtte Lewis -strukturen er den fra etanol ch ch3Ch2Åh. Imidlertid hadde det også vært riktig å foreslå strukturen til dimetyleteren3Och3, som er enda mer symmetrisk.
Hvilken av de to er "mer" riktig? Begge er like, siden strukturene oppsto som strukturelle isomerer av den samme molekylære formelen C2H6ENTEN.
Permanganate ion
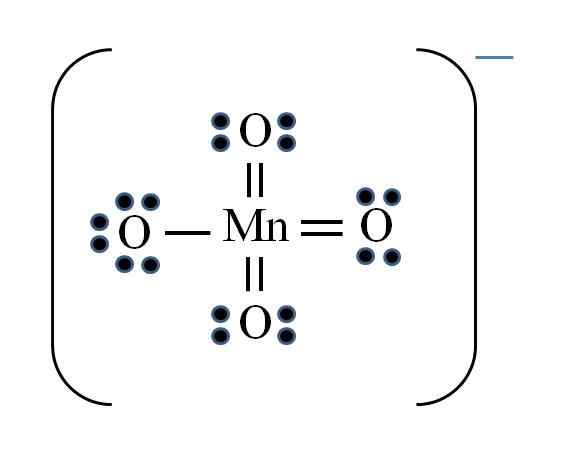 Kilde: Gabriel Bolívar
Kilde: Gabriel Bolívar Situasjonen er komplisert når du vil gjøre Lewis -strukturer for overgangsmetallforbindelser. Manganen tilhører VIIB -gruppen, også elektronet for den negative belastningen må tilsettes blant de tilgjengelige elektronene. Bruke formelen du har:
D = 7 × 1 (et manganatom) + 6 × 4 (fire oksygenatomer) + 1 elektron per belastning = 32 elektroner
N = 8 × 1 + 8 × 4 = 40 elektroner
C = 40 - 32 = 8 delte elektroner
C/2 = 4 lenker
Imidlertid kan overgangsmetaller ha mer enn åtte elektroner i Valencia. Også for mno -ionen4- Viser den negative belastningen, det er nødvendig å redusere de formelle belastningene med oksygenatomer. Som? Gjennom de doble lenkene.
Hvis alle MNOs lenker4- De var enkle, de formelle belastningene på oksygenet ville være lik -1. Siden det er fire, vil den resulterende belastningen være -4 for anion, noe som tydeligvis ikke er sant. Når dobbeltbindingene dannes, er det garantert at en enkelt oksygen har en negativ formell belastning, reflektert i ionet.
I permanganationet kan det sees at det er resonans. Dette innebærer at den eneste enkle MN-O-koblingen blir demokalisert mellom de fire atomene i O.
Dicromato ion
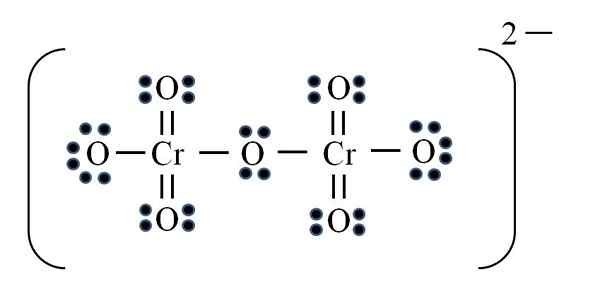 Kilde: Gabriel Bolívar
Kilde: Gabriel Bolívar Til slutt oppstår en lignende sak med dikromationen (CR2ENTEN7). Kromet tilhører Vib -gruppen, så den har seks elektroner av Valencia. Bruke formelen igjen:
D = 6 × 2 (to kromatomer) + 6 × 7 (syv oksygenatomer) + 2 elektroner ved den divalente belastningen = 56 elektroner
N = 8 × 2 + 8 × 7 = 72 elektroner
C = 72 - 56 = 16 delte elektroner
C/2 = 8 lenker
Men det er ingen 8 lenker, men 12. Av de samme grunnene som ble funnet, må to oksygen i permanganionet være igjen med negative formelle belastninger som tilfører lik -2, belastningen på dikromationen.
Dermed blir så mange dobbeltkoblinger lagt til etter behov. På denne måten når du Lewis -strukturen til bildet for CR2ENTEN72-.
Referanser
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). Cengage Learning, s 251.
- Lewis strukturer. Tatt fra: Chemed.Chem.Purdue.Edu
- Steven a. Hardinger, Department of Chemistry & Biochemistry, UCLA. (2017). Lewis -struktur. Hentet fra: Chem.UCLA.Edu
- Wayne Breslyn. (2012). Tegning av Lewis -strukturer. Hentet fra: terpconnect.Umd.Edu
- Webmaster. (2012). Lewis ("Electron Dot") strukturer. Department of Chemistry, University of Maine, Orono. Hentet fra: Kjemi.Umeche.Maine.Edu
- Lancaster, Sean. (25. april 2017). Hvordan bestemme hvor mange prikker som er på et elements Lewis Dot -struktur. Scienting. Gjenopprettet fra: Scienting.com

