Sekundær struktur av egenskaper proteiner

- 1981
- 21
- Daniel Skuterud
De Sekundær proteinstruktur Det er navnet som definerer konformasjonen brettet lokalt for noen deler av polypeptidkjeden. Denne strukturen består av flere mønstre som gjentas regelmessig.
Det er mange måter som proteinerkjeder er brettet. Imidlertid er bare noen få av disse formene veldig stabile. I naturen er de hyppigste formene som proteiner skaffer seg α -propellen så vel som β -arket. Disse strukturene kan beskrives med koblingsvinkler ψ (Psi), og φ (Phi) av aminosyreavfall.
 Skjema og modell av baller og stenger av Alfa -heliksen av proteiner (sekundærstruktur). Tatt og redigert fra: Alejandro Porto [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)].
Skjema og modell av baller og stenger av Alfa -heliksen av proteiner (sekundærstruktur). Tatt og redigert fra: Alejandro Porto [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Interaksjonene som er etablert mellom sidekjedene til aminosyreavfall kan bidra til å stabilisere eller tvert imot destabilisere den sekundære strukturen til proteiner. Sekundærstruktur kan observeres i konstitusjonen av mange fibrøse proteiner.
[TOC]
Historie
I tiåret av 30 -årene av forrige århundre fant William Atsbury, som jobbet med x -stråler, at hårprotein, så vel som for Porcospin -pigger, besatt i deres struktursegmenter som ble gjentatt regelmessig.
Basert på disse resultatene, og med kunnskapen om viktigheten av hydrogenbindinger i orienteringen av polare gruppene av peptidbindinger, bestemte William Pauling og samarbeidspartnere, følgelig bestemte de hypotetisk de mulige regelmessige konformasjoner som proteinene kunne ha.
Pauling og hans samarbeidspartnere, på 1950 -tallet, etablerte flere postulater som måtte oppfylles i koblingene til polypeptidkjedene, inkludert, og i utgangspunktet, at to atomer ikke kan nærme seg hverandre i en avstand mindre enn deres avstand fra deres respektive Radioer av van der Waals.
De indikerte også at ikke -kovalente koblinger er nødvendige for å stabilisere foldingen av kjedene.
Kan tjene deg: seksuell reproduksjonBasert på disse postulatene og forkunnskapen, og ved bruk av molekylære modeller, klarte de å beskrive noen regelmessige konformasjoner av proteiner, inkludert, som deretter ble demonstrert at de var de hyppigste i naturen, for eksempel propell α og lamina β β β.
Propell α
Det er den enkleste sekundære strukturen, der polypeptidkjeden er anordnet i en rullet og komprimert form rundt en tenkt akse. I tillegg skiller sidekjedene til hver aminosyre seg ut fra dette heliske skjelettet.
Aminosyrer er i dette tilfellet ordnet på en måte som de har koblingsvinkler ψ Fra -45 ° til -50 °, og φ av -60 °. Disse vinklene refererer til koblingen mellom α -karbonet og oksygenet til karbonylen og bindingen mellom henholdsvis nitrogenet og α -karbonet til hver aminosyre.
I tillegg har forskere bestemt at for hver α -propellforvendelse blir 3,6 aminosyreavfall presentert og at denne svingen alltid er dextrogyry i proteiner. I tillegg til å være den enkleste strukturen, er a-propellen den dominerende formen i a-queratinas og omtrent 25% av aminosyrene til kuleproteiner tar i bruk denne strukturen.
Α -propellen er stabilisert takket være det faktum at den presenterer mange hydrogenbroer. Dermed er tre eller fire lenker av denne typen etablert i hver propellsving.
I hydrogenbroene interagerer nitrogenet til en peptidbinding og oksygenatomet i karbonylgruppen til den påfølgende aminosyren, i retning av den amino-terminale siden av den kjeden.
Forskere har vist at en α-propell kan dannes med polypeptidkjeder dannet av L- eller D-aminosyrer, med betingelsen at alle aminosyrer har samme stereoisomera-konfigurasjon. I tillegg kan naturlige L-aaminosyrer danne α-dronder med både høyre og venstre.
Kan tjene deg: immunoglobulin dImidlertid kan ikke alle polypeptider danne stabil α -propell, fordi deres primære struktur påvirker stabiliteten til dette. R -kjedene til noen aminosyrer kan destabilisere strukturen og forhindre dannelse av propellene α.
Β -ark
I ß -arket, eller brettet β -arket, har hvert av aminosyreavfallet en 180 ° rotasjon i forhold til den foregående aminosyreresten. På denne måten oppnås det som et resultat at skjelettet til polypétidkjeden er utvidet og i en sikksagging eller trekkspillform.
Puldet akkord -formede polypeptidkjeder kan plasseres ved siden av hverandre og produserer lineære hydrogenbroer mellom begge kjeder.
To tilstøtende polypeptidkjeder kan være anordnet parallelt, det vil si at begge kan være orientert i amino -karboksylretningen, og danner det parallelle β -arket; o De kan være plassert i motsatte retninger, og danner deretter β antiparalla -arket.
Sidekjedene til tilstøtende aminosyreavfall skiller seg ut fra kjeden i kjeden i motsatte retninger, og gir opphav til et vekslende mønster. Noen proteinstrukturer begrenser typene aminosyrer av ß -strukturer.
For eksempel, i tettpakket proteiner, er aminosyrer på kort kjede, for eksempel glycin og alanin på kontaktflatene deres hyppigere.
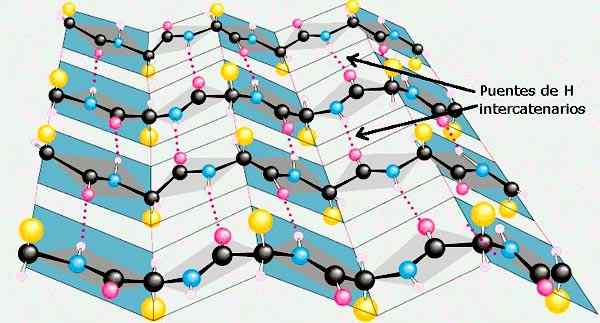 Β -arket til de sekundære strukturene til proteiner. Tatt og redigert fra: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)].
Β -arket til de sekundære strukturene til proteiner. Tatt og redigert fra: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Andre konformasjoner av sekundærstruktur
Helix 310
Denne strukturen karakteriseres ved å presentere 3 aminosyreavfall per runde. Denne strukturen har blitt observert i noen proteiner, men den er ikke veldig hyppig i naturen.
Helix π
Denne strukturen har i mellomtiden 4,4 aminosyreavfall fra spiralvending og en 16 -elements hydrogenkoblingssløyfe. Selv om denne konfigurasjonen er sterisk mulig, har den aldri blitt observert i naturen.
Kan tjene deg: Dextrose Potato Agar: Foundation, Preparation and UseDen mulige årsaken til dette kan være det hule sentrum, for stor til å tillate ytelsen til van der Waals -kreftene som vil bidra til å stabilisere strukturen, og det er imidlertid for lite til å tillate passering av vannmolekyler.
Superscundaria -struktur
Superscundary strukturer er kombinasjoner av sekundære strukturer av α og brettede ark β β -ark. Disse strukturene kan forekomme i mange kuleproteiner. Det er forskjellige mulige kombinasjoner, som hver har spesielle egenskaper.
Noen eksempler på SuperSecundarias -strukturer er: enhet βαβ, der to parallelle β -ark er koblet sammen med et α -propellsegment; de enhet αα, preget av to påfølgende aik.
Flere β -ark kan trekke seg tilbake på seg selv og gi en konfigurasjon av Tønne β, mens et antipaallala β -ark trukket tilbake om det utgjør en superscundaria -struktur som kalles Gresk nøkkel.
Referanser
- C.K. Mathews, k.OG. Van Hold & K.G. Ahern (2002). Biochemery. 3. utgave. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, p. Mayes, d.C. Granner & V.W. Rodwell (1996). Harper's Biochemery. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko & l. Stryer (2002). Biochemery. 5. utgave. W. H. Freeman og selskap.
- J.Koolman & K.-H. Roehm (2005). Atlas of Biochemistry Color. 2. utgave. Thieme.
- TIL. Lehninger (1978). Biokjemi. Omega Editions, S.TIL.
- T. McKee & J.R. McKee (2003). Biokjemi: det molekylære livets grunnlag. 3Rd Utgave. McGraw-HIII Companies, Inc.
- « Elastiske sjokk i en dimensjon, spesielle tilfeller, øvelser
- Gjeldende verdiegenskaper, formler og eksempler »

